일단 현재까지 자연계에서 알려진 코로나바이러스 중에서 SARS-CoV-2와 가장 비슷한 것은 이 녀석입니다. 박쥐에서 발견된 놈입니다. 그리고 우한에서 제일 먼저 발견된 SARS-CoV-2의 서열은 이것입니다. 이 두 개를 비교해보도록 하죠. 직접 비교할까 했습니다만 이미 다른 사람들이 다 해놨습니다. 이 논문의 Table 1을 봅시다. SARS-CoV-2와 이들과 가장 가까운 바이러스들을 비교했습니다.
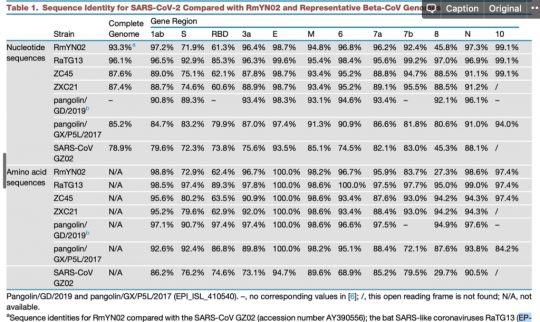
현재까지 SARS-CoV-2와 가장 가까운 바이러스인 RaTG13은 전체 지놈 기준으로 핵산 서열의 일치도가 96.1%입니다. 그 이야기는 3.9%의 핵산 서열이 다르다는 것이고, SARS-CoV-2의 지놈이 길이가 30,000 염기이므로 약 1,000염기 이상이 다르다는 것입니다. 이 중 가장 상동성이 떨어지는 것은 바이러스의 스파이크 단백질 유전자인 ‘S’ 유전자이고, 그중에서도 직접 세포의 수용체인 ACE2와 결합하는 영역인 RBD 부분입니다. 바이러스의 다른 부분은 E 유전자와 같이 바이러스에서 전반적으로 매우 유사한 부분도 있지만 그래도 꽤 많은 차이(88-95% 정도의 염기 일치도) 있습니다.
스파이크 단백질의 RBD 부분이 왜 가장 빈번하게 바뀌는가? 는 쉽게 유추할 수 있습니다. 많은 종류의 숙주에서 증식하려면 일단 세포에 침투해야 하고, 이 부분과 숙주 세포의 수용체와의 상호작용이 필수적입니다. 그런데 숙주의 수용체는 다 다르고… 이를 위해서는 여기에 돌연변이가 많이 일어나서 각각의 환경에서 최적의 환경을 보이는 놈들이 선발된 셈입니다. 즉, 진화에서의 선택압이 가장 높은 지점이라고 할 수 있겠죠. 요 논문에 보면 스파이크 단백질, 특히 RBD 영역의 서열을 비교해 둔 게 있네요.
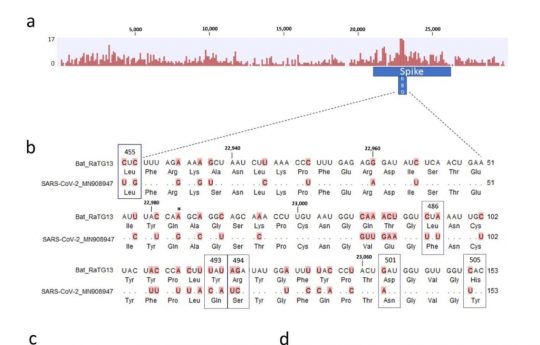
당연한 것입니다만, RBD 부분처럼 돌연변이가 많이 일어나는 부분에서도 핵산의 변이가 다 아미노산 변화를 유발하지는 않습니다. 돌연변이가 유발되어도 아미노산의 변화를 유발하지 않는 synonymous mutation(코돈의 세 번째에 주로 생기는) 가 아미노산을 바꾸는 변이보다도 더 많습니다. 그 이유는 어쩌면 당연합니다. 돌연변이가 생기면 바이러스의 생존 자체에 문제가 있는 부분과, 바뀌어도 좋은 부분이 있습니다. 그나마 많은 돌연변이가 생기는 RBD 부분에서도 아미노산에 돌연변이가 생기는 것은 한정적입니다.
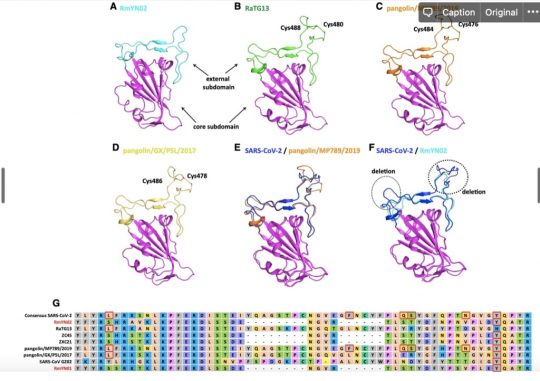
RBD 도메인에서 일어나는 변화는 단순히 아미노산 바이러스 변화뿐 아니라 삽입된 서열(혹은 삭제된 서열)이 있습니다. 박쥐에서 발견된 일부 바이러스에는 SARS-CoV-2나 RaTG13에는 존재하는 삽입된 서열이 존재하지 않습니다. 삽입된 서열은 저 위의 구조에 보이는 루프 구조(꼬불꼬불하게 라면 가닥처럼 되어 있는 부분)를 형성합니다.
이런 서열의 삽입과 추가는 바이러스마다 다 ‘그때그때 달라요’입니다. 가령 박쥐에서 발견된 RMYN02 라는 바이러스는 RBD 도메인의 삽입 서열이 없다는 것에서 SARS-CoV-2 와는 다르지만, 스파이크 단백질의 다른 부분에서 SARS-CoV-2 에만 공통적으로 있다고 생각하던 삽입 서열이 있습니다.
그리고 이런 서열은 천산갑에서 발견된 바이러스들은 전체적으로는 박쥐의 바이러스보다 거리가 멀지만 삽입 서열이 있습니다. 누군가는 기존에 밝혀진 박쥐의 RBD 도메인과 SARS-CoV2의 RBD 도메인이 너무나 다르고 거리가 먼 SARS-CoV에 있는 삽입 서열이 있다는 것이 인위적인 조작의 증거라고 하지만 위에서 보시면 천산갑 유래의 바이러스에도 존재하고, 이 서열은 SARS-CoV의 삽입 서열에 비해서는 상당히 다릅니다. 자기가 마음에 안 들면 다 주작임! 이라고 우기겠지…
위를 보면 SARS-CoV-2 에는 furin cleavage 사이트인 PRRA 서열이 있고, 일부는 이것이 혹시 인위적으로 조작된 증거가 아닌가 하는 궁예를 하기도 했습니다만, 뭐 나중에 발견된 자연계에 있는 다른 바이러스(RmYN02)에도 이 부분에 삽입 서열이 있는 경우가 있네요. 뭐 이것도 주작이라고 하겠네
d어쨌든 SARS-CoV-2와 가장 가까운 자연계에서 발견된 바이러스와 SARS-CoV-2 에는 약 4%의 서열 차이가 있고, 이는 1,000 염기 정도의 차이입니다. 이 변화는 바이러스 지놈 전체에 흩어져 있으며 (모 씨가 인공적인 바이러스 제조의 시작 지점이라고 주장한 ZC45와는 전체 지놈에 걸쳐 13%의 핵산의 차이가 있습니다) 염기의 차이 중 거의 대부분은 아미노산을 바꾸지 않는 돌연변이이고, 일부만 아미노산을 바꿉니다. 이들 아미노산 변이 중에서 어떤 것이 해당 바이러스들이 가지는 차이(가 있다면)를 유발하는지는 아직 잘 모릅니다.
즉 인위적으로 만들어진 바이러스로 보기에는 SARS-CoV-2 는 기존에 알려진 바이러스에 비해서 너무나 다른 바이러스이고 그 차이는 바이러스의 유전체 전체에 나타납니다.
이제 이런 가상의 상황을 생각해 보도록 합시다. 어떤 매드사이언티스트 (… )가 자연계에 있는 코로나바이러스를 분리해 이것을 뜯어고쳐서 닝겐에게 더 잘 퍼지는 바이러스를 만들어서 생물학 테러 같은 것을 일으키고 싶다고 해 봅시다.

일단 바이러스 유전체를 인공적으로 조작할 수 있는 기술 자체는 있습니다. 즉 바이러스를 DNA 형태로 만들어서 플라스미드 벡터에 넣고, 시험관에서 전사(Transcription)해 RNA를 만들고 감염시키는 것입니다. 이런 것은 바이러스를 연구하는 분들이 많이 사용합니다.
자, 이렇게 자연계의 바이러스에 돌연변이를 주고 조작을 할 준비를 했다고 합시다. 어디를 뜯어고치겠습니까? 감염력을 증대한다면 스파이크 단백질, 특히 RBD 도메인 등에 인위적인 조작을 주고, 조작된 바이러스를 만들어서 감염력을 테스트해서 제일 잘 감염되거나 병리학적으로 독성이 제일 강한 놈을 선발할 수는 있겠지요. 그렇다고 한다면 스파이크 단백질이나 RBD 도메인에 돌연변이라든지 인위적인 조작의 흔적이 남겠지요.
특별히 돌연변이를 준다고 해도 결국은 아미노산을 바꾸는 돌연변이여야 의미가 있을 것이므로 아미노산이 바뀌지도 않는 돌연변이를 만들지는 않을 것입니다. 그리고 이때의 조작도 상당히 한정적인 것이 될 것입니다. 돌연변이가 단백질의 기능과 바이러스의 기능에 어떤 영향을 미치는 걸 완벽히 예측하기는 매우 힘들기에 꼭 필요한 부분만을 고치려는 것이 대부분 생명공학자의 생각일 것입니다.
스파이크 단백질, RBD 도메인이 아닌 바이러스의 다른 부분을 뜯어고친다? 아이고… 스파이크 단백질 뜯어고치기도 힘든데 다른 부분은 또 왜… 뭐 일단 스파이크 단백질을 뜯어고치고 다른 부분을 더 ‘개량’ 한다고 하더라도 그때 역시 아미노산이 바뀌지도 않은 돌연변이를 넣지는 않을 것이고 극히 한정적으로 아미노산이 바뀌어서 바이러스의 성질이 바뀌는 그런 것을 찾을 것입니다. 엔지니어링을 할 때 굳이 ‘잘 돌아가는 다른 부분’을 고칠 필요는 없으니까요. 어차피 이런 부분들은 여러 코로나바이러스에서도 스파이크 단백질에 비해서 많이 바뀌지도 않았습니다.
그렇게 만들어진 바이러스는 아마 스파이크 단백질의 일부분, 혹은 지놈의 다른 부분에서 극히 일부분만 한정적인 돌연변이가 있는 그런 바이러스가 될 것입니다. SARS-CoV-2와 RaTG13의 차이처럼 약 1,000개 넘는 돌연변이가 있고(누군가가 바이러스의 템플리트로 사용되었다고 주장하는 바이러스와는 6,000개 넘는 염기서열의 차이가 있는), 대부분은 기능에 영향을 미치지도 않는 아미노산을 변화시키지도 않는 돌연변이가 있는 바이러스와는 많이 다르겠지요.
아, 자연계에 나온 바이러스처럼 위장을 해야 하므로 이 바이러스의 ‘개발자’ 는 진화원리에 따라서 적절히 아미노산이 안 바뀌는 돌연변이도 넣고 꼼꼼하게 하는 매드사이언티스트라고요? 그런데 그럴 때 주의해야 할 것이 아주 가끔은 아미노산이 달라지지 않아도 서열이 달라지면 단백질 발현 수준이나 등등이 달라지는 경우도 있답니다. 이런 돌연변이가 원하지 않은 결과로 나타날 수도 있고… 어쨌든 그러지 않아도 골치 아픈 일에 리스크 요소를 늘리지 않는 것이 좋습니다.

암튼 기술적으로 목표로 하는 서열이 주어진다면 그 서열과 동일한 바이러스를 인공적으로 만드는 것은 가능합니다. 그러나 기존에 있는 바이러스의 서열을 뜯어고쳐서 약 96-87%의 염기 상동성을 가진 미지의 서열을 가진 바이러스를 만들고, 이것에 더 감염이 잘 되는 등 어떤 새로운 성질을 부여하는 것은 다른 문제입니다. 물론 기존의 세균의 지놈을 뜯어고쳐 불필요한 유전자를 없애서 약 30% 정도의 지놈을 날려버린 세균 같은 것은 있었습니다. 그러나 이때는 날려 버려도 사는 데 지장 없는 유전자를 통째로 날려 버린 것이고, 개개의 유전자의 단백질의 서열을 고치려고 한 것은 아니라는 것이라는 것을 기억할 필요가 있습니다.
물론 바이러스를 ‘조작’ 하는 방법은 현대 유전공학적인 방법만 있는 것은 아닙니다. 사실 닝겐은 현대 유전공학이 대두되기 전부터 바이러스를 ‘조작’해 왔습니다. 무슨 말이냐고요? 약독화 백신입니다. 즉, 상당수의 백신은 살아있는 바이러스입니다. 이를 만드는 방법은 바이러스를 자신이 병을 일으키는 숙주와는 조금 다른 환경에서 아주 오래 키우는 것입니다. 바이러스를 오래 키우다 보면 돌연변이가 누적되고 그 성질이 변합니다.
즉 병을 일으키는 숙주와 다른 환경에 살다 보면 자연스럽게 여기에 적응하는데 유리한 돌연변이가 축적되고, 이런 돌연변이는 원래의 병원성을 약화할 수도 있습니다. 이런 식으로 만들어진 백신 중의 대표적인 것이 황열병 백신으로써, 황열병 백신은 원래의 숙주인 원숭이 혹은 닝겐이 아닌 수정란에서 오랫동안 계대배양을 해 병원성을 잃어버리도록 한 바이러스입니다. 또 다른 것은 소아마비 백신 중 경구 투여를 할 수 있는 생백신으로써 이것은 사빈이라는 사람이 만들었습니다. 이 역시 발견된 소아마비 바이러스를 오랫동안 배양해서 얻어졌습니다.

그렇다면 병을 일으키는 바이러스와 인공적으로 오래 배양되어서 얻은 생백신은 얼마나 차이가 있을까요? 2002년의 이 논문에서는 강력한 소아마비를 일으키는 바이러스인 마호니 스트레인(Mahoney Strain)을 오랫동안 계대배양해서 만들어진 약독화 바이러스 (생백신)의 염기서열 차이를 분석했습니다.
마호니 스트레인과 약독화 바이러스는 핵산 기준으로는 54개가 다르고 20개의 아미노산이 바뀌었는데, 약독화에 관여하는 아미노산 변화는 딱 2개였습니다. 사빈은 이 바이러스를 얻기 위해 많은 사람의 쿠사리(너님은 언제 백신 만들래? 소크라는 사람은 벌써 다른 방법으로 만들었구만)를 먹으며 몇 년 동안 이 바이러스를 배양 또 배양해서 이걸 만들었습니다. 소아마비 바이러스의 경우 지놈 사이즈가 7,000 염기 정도입니다.
만약 이런 식으로 엄청나게 바이러스를 배양해서 더 짱 센 놈을 선발하는 식으로 자연적으로 일어나는 돌연변이에 의존해서 바이러스를 찾으면 얼마 정도 걸릴까요? 소아마비 바이러스와 코로나바이러스는 아마 돌연변이율이 다를 것이기에 직접적인 비교를 하기는 어렵습니다.
그렇지만 뭐 이 글이 진지 빨면서 하는 것은 아니므로(…) 소아마비 바이러스와 코로나바이러스가 비슷한 속도로 돌연변이를 일으킨다 치고, RaTG13에서 SARS-CoV-2의 변이만큼을 나올 시간은… 아마 사빈이 저걸 얻을 시간의 20배 (단순히 돌연변이 개수의 비율, 다를 수도 있음) 정도는 걸릴지도 모르겠군요.
그런데 우리는 이미 많은 양의 SARS-CoV-2의 지놈을 시퀀싱했고, 이를 통해 사람을 통해서 퍼질 때 이 바이러스가 어느 정도의 속도로 변화하는지 짐작 가능합니다. 지금 코로나바이러스가 수천만 명의 사람을 통해서 퍼지고, 이런 상황에서 코로나바이러스는 대충 1년에 20염기 정도로 변한다고 합니다. 그렇다면 이런 속도로 ‘사람 중에서’ 퍼질 때 약 1,000개 정도의 돌연변이가 생기려면… 50년?
그런데 이 상황은 수천만 명의 실험 대상 아니 인간을 통해서 바이러스가 퍼졌을 때 얻을 수 있는 상황입니다. 만약 매드사이언티스트가 연구실에서 한정적인 실험동물, 혹은 배양세포를 통해서 행한다면 어떻게 될까요. 물론 바이러스가 배양세포에서의 증식은 닝겐에서 자라는 것보다는 더 빠를 것이므로 증식이 빠르면 돌연변이 속도도 빨라질 수는 있습니다. 그러나 일단 무지막지하게 큰 스케일로 실험을 해야겠지요. 지놈의 4%를 바꾸는 것은 쉽지 않습니다.
좀 더 빠른 속도로 돌연변이를 얻기 위해 돌연변이 유도를 하는 화합물이나 X선 같은 것을 써 볼까요. 물론 그렇게 해 돌연변이 속도를 높일 수는 있을 것입니다. 그러나 그것이 더 빠른 표현형의 변화를 얻는 좋은 방법은 아닐 수도 있습니다. 일단은 그렇게 얻어진 돌연변이 바이러스가 실제 표적이 되는 곳에서 어떻게 활동할지는 ‘실험’을 해봐야 압니다. 그걸 어떻게?
얻어진 돌연변이 바이러스를 막 주변에 퍼트려서 전파력을 검사한다? 현실적인 방법은 아닙니다. 세포 시스템에서 바이러스의 감염력을 조사하는 것도 대안입니다만, 암튼 수년 동안 정량적으로 조사해야겠지요. 전 세계적인 판데믹을 유발할 수 있도록 무증상자도 적당히 나오면서 위험군에 치명적으로 작용하는 바이러스로 만들기 위해서……. 아 머리 아프군요.
어쨌든 유전공학적인 방법을 사용하든, 오래오래 배양하면서 돌연변이를 기대하든 이 정도의 유전적인 변화를 닝겐이 일으키는 것은 쉽지 않습니다. 닝겐이 동물이나 식물을 육종할 때는 서로 교배하면서 유전체를 쉐킷쉐킷 해주는 그런 꼼수가 있었고, 실제로 이렇게 교배를 통해 유전 정보를 교환하는 것은 유전정보의 다변화에 좋은 방법입니다. 그러나 바이러스는 유전자 교환의 주요 방법인 쒝스도 못합니다….
혹시 다른 유전정보를 가진 바이러스들이 동시에 감염되면 복제되는 와중에 유전정보 교환이 일어나지 않을까요? 실제로 바이러스의 지놈들을 찾아보면 서로 다른 종간의 바이러스 간의 재조합의 흔적이 보이기는 합니다. 그러나 그리 일반적으로 일어나는 일은 아닐 것입니다. 모르죠… 세포주를 조작해 바이러스 간 유전정보 교환,즉 쒝스를 위해서 또 다른 시스템을 설계…. 아 너무 복잡합니다. 이러다 보면 아무리 대단한 매드사이언티스트라도 현타가 몰려올 것입니다.
여기는 누구인가. 나는 누군가. 나는 뭘 하는가.
사빈 아재야 백신을 만들기 위한 목적이라도 있었지만 RaTG13에서 SARS-CoV-2으로 바이러스를 바꾸는 것은 도대체 어떤 목적인지도 모릅니다. 그나마 바이러스 유출의 시나리오로 가장 그럴싸한 것은 SARS-CoV-2가 이전에 동물 등에서 기 분리된 (박쥐 등이 코로나바이러스의 소스였으므로 박쥐 등에서 바이러스를 수집하는 연구는 많이 진행 중입니다) 바이러스였는데 연구소에서의 어떤 문제나 실수 등으로 바이러스가 유출되는 정도일 것입니다. 물론 이런 것이 우한에서 일어났다는 것을 입증할 자료는 당연히 없습니다. 그러나 어쨌든 인위적인 바이러스 개조보다는 훨씬 더 일어나기 쉬워 보입니다.
어쨌든 요약을 하면 이렇습니다.
- 현재까지 알려진 바이러스로부터 SARS-CoV-2를 인공적으로 만드는 것은 엄청나게 어렵고 사실 그런 것을 해야 할 목적도 모르겠다.
- 아주 오래 인공적으로 배양하면 변화된 바이러스를 얻을 수 있을지는 모르겠지만 그렇게 하려 해도 최소 수십 년은 걸릴 것이다.
- 차라리 이전에 자연계에서 분리된 바이러스가 유출되었을 가능성이 1, 2보다는 높다. 물론 3을 입증하는 증거는 아직까지는 없다.
- 바이러스를 개조해서 우리가 원하는 능력을 만들게 하는 것은 더 어렵다. 생명공학을 과대평가하시는 것은 업계인으로 감사합니다만 우리는 아직 그 정도의 능력이 없는 찌질입니다 ㅠㅠㅠ
원문: Secret Lab of Mad Scientist
함께 보면 좋은 글
이 필자의 다른 글
