※ 「“이런 걸 연구해봐야 밥이 나오냐 쌀이 나오냐” 하던 어떤 연구의 말로 (전편)」에서 이어집니다.
이제 이십 년 전에 박테리아 유전자 근처에서 발견되었던 희한한 시퀀스 하나는 많은 과학자들의 관심을 끌게 되는 유전자가 되었다. 물론 여전히 ‘박테리아도 면역이 있네~ 세상에 희한한 일도’ 수준의 관심이랄까. 관련 분야 덕후 학자들의 입장으로는 매우 흥분되는 일이었지만, 일반인이나 (요구르트 업계를 제외한) 산업계, 매스미디어가 크게 관심을 끌 일은 아니었다.
그러나 이들 대다수, 심지어 해당 연구를 수행한 연구자들도 앞으로 몇 년 후에 벌어질 일에 대해서는 예상하지 못한 상태였다.
4. 2010. 그래서 미생물도 한번 감기가 걸리면 그 이후에는 잘 안 걸리는 건 알겠는데, So what?
미생물의 적응면역이라는 신기한 토픽이 모 럭숴~리 저널에 한번 뜬 이후에 꽤 많은 덕후관련 분야 학자, 혹은 꼭 관련분야가 아니었던 학자들의 관심을 끌게 되었다. 주로 이전까지는 미생물을 연구하던 분자생물학자/분자유전학자들이 주로 관심을 가졌다면 이제는 생화학자/구조생물학자 등 개별 단백질의 기능을 연구하는 사람들 역시 이 희한한 현상에 관심을 갖게 되었다고나 할까. 유전학자들이 대충 깨작깨작 그러놓은 그림을 실제 화학반응과 분자구조로 구체화하는 것은 언제나 불쌍한 생화학자와 구조생물학자의 몫.
어쨌든 요쿠르트 회사의 하라는 연구는 안 하고 엉뚱한 연구를 하던 연구자 2인은 그동안의 연구결과들을 종합하여 다음과 같은 리뷰를 쓰게 되었다.
- 파지가 박테리아 안으로 자기 DNA를 찔러넣어!
왼손으로 DNA를 잘 파지했다. 세균 안으로 잘 투척! -
그러면 박테리아 세포 내의 CAS 단백질 컴플렉스가 “어딜 감히?” 하고 파지 DNA에 척~ 붙어서 슥삭슥삭…
-
일단 잘라놓은 넘이 나중에 또 들어오면 어쩌지? 지놈 안에 붙여놓자.
나의 지놈은 포스트잇20bp 단위로 잘라서 차곡차곡 여태까지 들어오려고 했던 넘들 것과 잘 모아두어용. 책갈피로 잘 구분해 두고. (이 책갈피가 바로 CRISPR에 나오는 Repeat.) -
DNA에 들어있는 ‘파지 DNA 조각 모음’은 RNA로 카피되고, 이건 잘 잘라서 crRNA라는 조각이 되고, 이것은 cas9라는 단백질과 붙어서 또 Phage가 들어오는지 잘 감시~
-
한 번 들어왔던 놈이 들어오면 crRNA 와 붙는지 보고, 붙으면 와락~ 하고 잘라버림.
들어갈 땐 마음대로지만 나갈 땐 아니란다. (철썩)
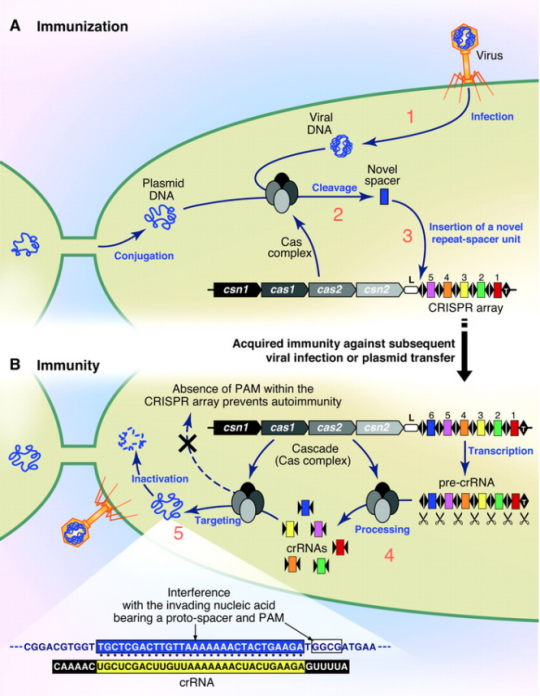
물론 이러한 그림에 해당하는 단백질들이 어떻게 생겼는지, 어떻게 촉매작용을 수행하는지는 생화학자, 구조생물학자 너님들이 하셈~ 뭐 어쨌든 지금 현재까지도 “참 신기한 일이 다 있네~ 근데 왜 이런데 국민의 혈세를 낭비하지? 이런 것을 하면 쌀이 나오냐, 밥이 나오냐…” 하던 사람이 있었을지도. 그러나 이미 이 시점에서도 내공이 높은 덕후학자들은 이 건을 좀 뒤지면 뭔가 쩐이 될만한 게 나오리라는 낌새를 채고 있었다.
5. 2012. Programmable Restriction Enzyme
이렇게 요구르트 가이 2명이 던진 떡밥을 문 구조생물학자 중 한 명이 버클리에 사는 제니라는 눈화였다. 제니 눈화의 전공이 원래 RNA를 쓱삭쓱삭 자르는 효소들이 어떻게 생겨먹었냐거든. 여러 가지 일을 했지만, 이전에 한 일은 진핵생물에 있는 어떤 쬐끄만 RNA를 자르는 효소의 구조를 밝힌 것 등등. 어쨌든 저 업계에서는 좀 네임드라고 알아주는 양반이라고 생각하면 된다.
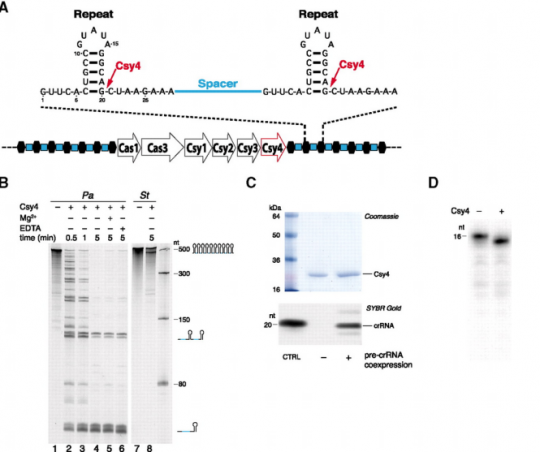
첫 번째로 한 일은 CRISPR에 코딩되어 있는 바이러스 RNA 쪼가리들이 어떻게 각각 잘리는지를 본 일.
CRISPR가 일단 RNA 형태로 전사된 다음, CRISPR와 같이 따라다니는 유전자 중 CSR4 라는 넘이 리핏으로 구분된 스페이서(파지 DNA 쪼가리)를 슥슥 자르는데,
리핏 부위의 stem-loop를 인식해서 자른다는 것을 밝혔다.
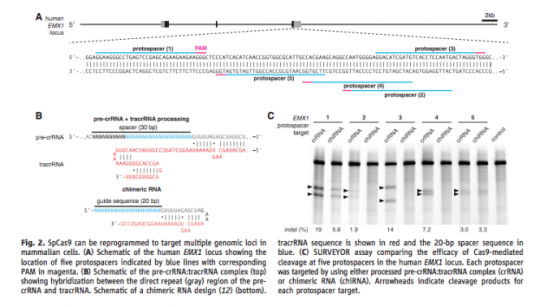
다음 스텝은 이렇게 만들어진 crRNA가 어떻게 파지 DNA를 자르느냐인데, 2012년 매우 결정적인 단서가 되는 연구를 스웨덴의 그룹과 공동으로 역시 모 과학 주간지에 발표하였다.
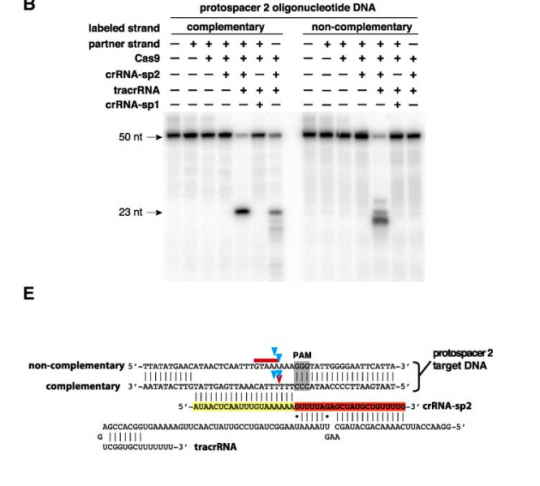
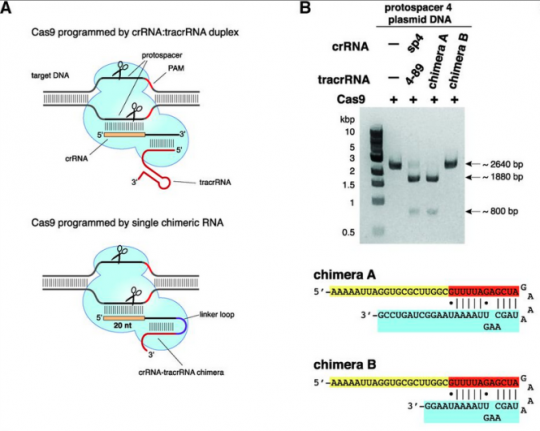
a. 파지의 DNA 를 자르려면 3가지가 필요하다. 즉 파지 DNA 시퀀스와 동일한 crRNA + 실제 DNA를 자르게 하는 단백질인 cas9 + crRNA 와 cas9을 연결하는 tracrRNA
b. 이 3가지를 넣으니 시험관 내에서 특정한 DNA를 자를 수 있어! 즉 CRISPR 시스템이 CRISPR에 들어있는 DNA 정보를 RNA로 변환한 다음, 이것을 이용하여 파지의 DNA를 자를 수 있다는 것을 입증한 셈이다.
c. crRNA와 tracrRNA를 이어도 DNA가 잘라져! 그 이야기는 단백질인 cas9과 실제로 자를 서열의 DNA에 상응하는 RNA정보인 sgRNA 이 두 가지만 있으면 DNA를 자를 수 있는 단백질 + RNA 하이브리드가 생기는 셈이다.
그런데 여기서 중요한 포인트. 그렇다면 파지 DNA만 잘릴까? 즉 sgRNA에서 target과 상동성이 있는 시퀀스만 바꿔주면 sgRNA의 서열에 상응하는 어떤 DNA만 자를 수 있다는 것을 확인하였다. 즉 이들은 여기서 RNA 서열만 바꾸어주면 자를 시퀀스를 결정해주는 ‘Programmable Restriction Enzyme’을 만든 것이다.
분자생물학에 약간의 지식이 있는 업자분들이라면 이게 무슨 의미인지 아실 거다. 기존의 ‘유전자 재조합 기술’에 사용되던 제한효소는 대개 6bp, 길어봐야 8bp 정도의 서열을 인식하는 효소였고, 어떤 서열을 인식하는지는 고정되어 있었다. 그러나 이제 약 20bp 정도의 시퀀스를 인지하여 정확하게 자를 수 있게 된 것이다.
‘그게 어쨌다고?’ 생각하는 분들을 위해서 빨리 다음으로 넘어가자.
6. 2013. 고등생물의 지놈을 사각사각~
사실 유전자 재조합 기술이 나온 것은 1970년대이긴 하지만, 이것을 쉽게 비유하자면 수백만 권의 책이 꽂혀있는 도서관에서 책 하나만 어쩌다 대출해서 깨작깨작 낙서해서 다시 꽂아놓는 정도랄까, 즉 지놈 스케일에서 유전자를 마음대로 조작하는 것은 공상과학 소설에서나 나오는 이야기처럼 취급되었다. 그 이유는 앞에서 설명한 것처럼 수억 bp에 달하는 염색체에서 원하는 부분만을 슥 잘라서 갈아끼는 것이 힘들었기 때문.
기존에 사용되던 제한효소는 대개 6~8bp 정도의 서열을 특이적으로 인식한다. (퀴즈. 그러면 2억 bp에 달하는 염색체를 6bp를 특이적으로 인식하는 제한효소는 몇 조각을 낼 수 있을까?) 한마디로 말해서 이런 무딘 칼을 가지고 정밀하게 지놈을 깨작거리는 것은 그다지 쉬운 일이 아니었다고나 할까.
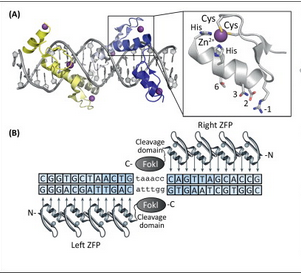
그러나 약 10년 전부터 이런 한계를 극복하고 10bp 이상을 인식하여 임의의 지놈 영역을 잘라서 붙일 수 있는 방법들을 개발하고자 여러 가지 시도가 진행되었다. 첫 번째 시도는 Zinc-Finger Nuclease.
즉 DNA 결합영역으로 유명한 Zinc Finger 모티프에 Nuclease를 달아서 ① 임의의 DNA를 인식시키고, ② 이를 잘라보려고 하던 시도였다. 그러나 ① 인식가능한 염기가 약 10bp 정도밖에 되지 않아아서 Off-site effect (원하지 않던 부분도 슥슥 잘라버리는)가 심했고, ② 특정한 염기를 인식하려면 이를 인식할 수 있도록 복잡한 유전자를 만들어야 하는데, 이 과정이 극히 번거로웠고 ③ 결정적으로 효율이 그다지 높지 않았다는 문제가 있었다.
두 번째 시도는 TALEN (Transcription activator-like effector nuclease)
이것은 식물 병원균 유래의 DNA 결합부위에 Nuclease를 달아서 역시 선택적으로 DNA를 인식하여 잘라보려고 하던 시도였다. (작년에 다룬 적이 있는 이야기. 안됐어 TALEN 너의 전성기는 고작 1년뿐 ㅋ ) ① ZFN에 비해서 약 15bp 정도를 인식할 수 있게 되었으므로 좀 더 특이성이 강화되었다는 장점이 있었으나, ② 역시 특정한 염기를 인식하려면 아래와 같은 복잡한 유전자를 합성해야 한다는 단점이 있었으므로, ③ 역시 효율은 생각만큼 높지 않았다는 단점이 있었다. (DNA 결합부위는 다르지만 자르는 것은 결국 ZFN과 마찬가지로 FokI Cleavage Domain을 사용)
그런데 이제 나온 CRISPR/Cas의 경우에는 ZFN/TALEN과는 다르다, ZFN/TALEN과는!
a. ZFN이나 TALEN의 경우 특정 염기서열을 인지하려면 수백 아미노산이 되는 (DNA로는 수천 bp가 되는) 합성 유전자가 필요. 그러나 CRISPR는 고작 100bp 이내의 RNA 서열만 있으면 그만. 그 정도는 합성으로 한 번에 해결 가능. sgRNA만 갈아 끼우면 얼마든지 새로운 서열을 인지하는 제한효소가 탄생.
TALEN으로 시퀀스 하나 뜯어고치려면 이 정도 길이의 유전자를 새로 만들어야 하는데
CRISPR/Cas로는 요거면 됩니다. 뭘 선택할래 물어보는 게 뻘쭘할 지경.
b. 효율이 더 높다. 한 마디로 말해서 ‘더 잘 자른다’인데, 어쩌면 당연한 일일지도 모르는게, DNA binding domain에 어거지로 DNA를 자르는 도메인을 달아놓은 인공효소보다 원래 RNA template를 가지고 DNA를 자를 수 있게 ‘진화’된 cas9 쪽이 더 효율적으로 DNA를 자른다는 게 서로 비교를 통해서 판명되었다.
CRISPR/Cas 시스템이 ZFN이나 TALEN에 비해서 강점을 가지고 있다는 것을 눈치깐 기존의 지놈엔지니어링 하던 랩들은 우루루 CRISPR/cas 시스템으로 몰려가기 시작했다. 그래서 2013년 초에 3개의 논문이 동시에 튀어나와 이 시스템으로 실제로 고등동물 유전체를 변형시킬 수 있다는 것을 확인했다.
이들 중 MIT의 Feng Zhang. 이 친구는 원래 Optogenetics 하던 친구다.
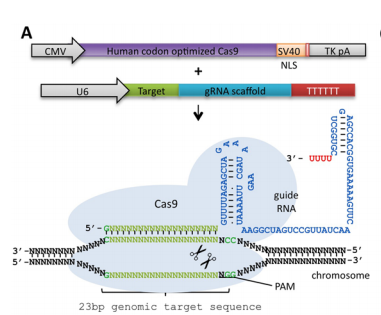
Cas9과 sgRNA를 셀라인에서 발현해서 특정 위치를 ‘일단 잘랐다’가 세포 내의 blunt end repair 기작으로 복구된 곳에서는 제대로 복구가 되지 않아서 잘못된 베이스가 튀어나온다는 것을 발견
그리고 이런 데 안 낄 리가 없는 하버드의 George Church(일명 교회 아저씨… 돈냄새를 잘 맡으시는 것과 성과의 관계는?) 아저씨 역시 거의 비슷한 내용으로 백투백으로 사이언스에 논문 투척.
거의 비슷한 구성. cas9 단백질 + 원하는 시퀀스에 Cas9에 붙는 Guide RNA만 있으면 지놈 자르기 가능. 여기서 중요한 것은 약 23bp 정도의 서열 뒤의 제일 끝에는 NCC로 끝나는 서열이 있어야 함.
DNA 잘라서 복구하는 활성을 TALEN과 비교… 빠이빠이 TALEN.
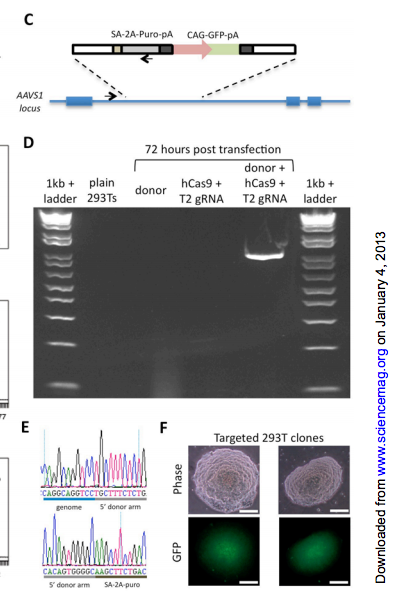
잘라 붙이기 활성으로 GFP를 지놈 안에~
7. 2013. 원스텝에 낙아웃 쥐를 만들어보셈
여기서까지는 체외에서 배양한 셀라인에 대한 이야기다. 그렇지만 과연 살아있는 생물에서도 이렇게 유전체를 변형시킬 수 있는가? 사실 극히 한정된 모델생물(쥐, 초파리, 제브라피시)에 국한된 이야기지만, 기존에도 유전체를 변형하는 것은 가능하였다. (GMO 동물 무시하나염?) 그리고 원하는 유전자를 지놈 내에서 지워버리는(Knockout) 혹은 변형하는(KnockIn) 기술도 마우스와 같은 것에서는 가능했다.
그러나 기존의 기술은 비록 광범위하게 사용되고는 있었지만 몇 가지 문제가 있었는데,
a. 복잡. 배아줄기세포(Embryonic Stem Cell)에서 유전자 조작을 한 후, 이것을 배반포 상태의 마우스 수정란에 주입하여 키메라 마우스를 만들고, 키메라 마우스에서 생식세포로 전이되는 돌연변이를 가진 새끼를 찾아서 이것을 교배시키고…어쨌든 몇 번의 교배와 스크리닝을 거쳐서 얻을 수 있는 일이라고 생각하면 된다.
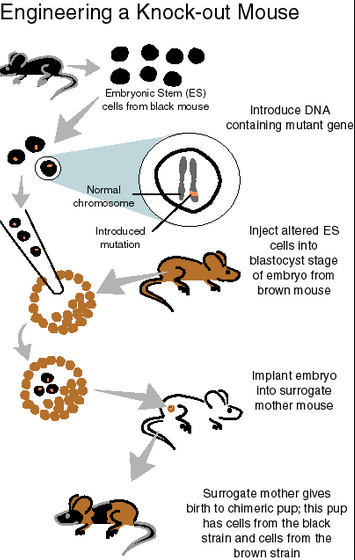
출처: LinguaMedica
b. 마우스만 돼. 심지어 ‘래트’도 쉽게 되지 않았다. 개, 소, 말, 돼지… 쏘리. 일단 배아줄기세포를 비교적 쉽게 확립할 수 있는 동물이 아니라면 낙아웃/낙인은 쉽지 않은 상태.
c. 여러 개의 유전자를 동시에 건드리려면? 각각을 따로따로 뮤테이션한 낙아웃 쥐를 만들고 쥐 1와 쥐 2를 교배해서…여기서 유전자가 3개 이상이 되면 그 시간과 노력은 기하급수적으로 늘어난다.
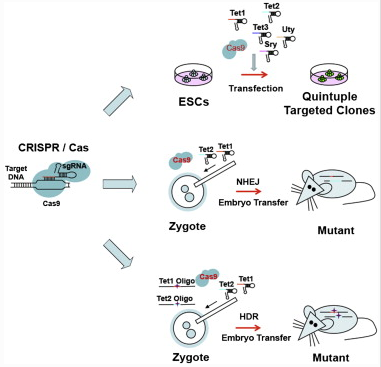
그러나 2013년에 MIT/화이트헤드의 루돌브 야니쉬와 앞서 말한 Feng Zhang(알만한 사람이라면 다 아는 사람)은 CRISPR/Cas를 이용하여 간단하게 낙아웃/낙인 쥐를 만들 수 있다는 것을 보여주었다.
a. 기존에 knockout mouse 만들던 방법대로 ES Cell에서 Cas9과 sgRNA를 이용하여 4개 유전자를 동시에 낙아웃하여 ES Cell을 배반포에 이식하거나
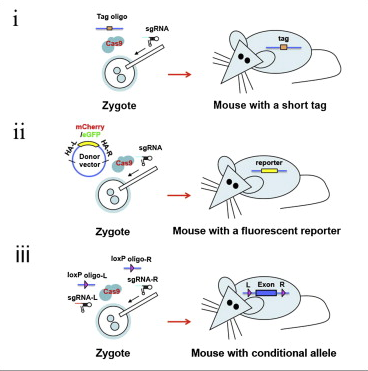
b. 아니면 마우스의 수정란 (1 Cell Embryo – Zygote) Cas9 과 sgRNA RNA를 Cytoplasm (이전에 형질전환 쥐를 만들 때처럼 Pronuclues에 injection을 하는 것이 아님. Cas9 와 sgRNA RNA를 injection하면 Translation 된 Cas9에 sgRNA가 붙어서 핵 안으로 들어감) 에 주입하면 핵 안으로 들어가 DNA을 쓱삭쓱삭~ 그다음에 배아 이식을 통해서 원스텝으로 쥐를 짜잔!
이번에는 Knock-In이다! 기존에 tissue-specific 한 deletion을 만들려면 특정한 locus에 loxP 사이트를 넣는 작업을 했어야 하는데 이 역시 ES Cell을 거치는 노가다 작업. 그러나 이것도 Cas9과 sgRNA를 zygote에만 주입하면 원스텝으로 끝나염.
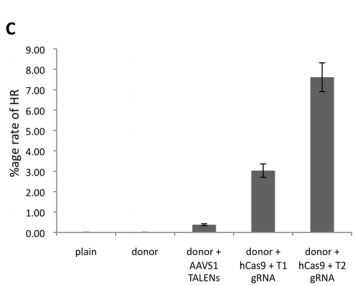
게다가 원하는 locus에 정확하게 GFP fusion을 이제 만들어 놓을 수 있다! (Santa Cruz Biotech가 이 뉴스를 싫어합니다.)
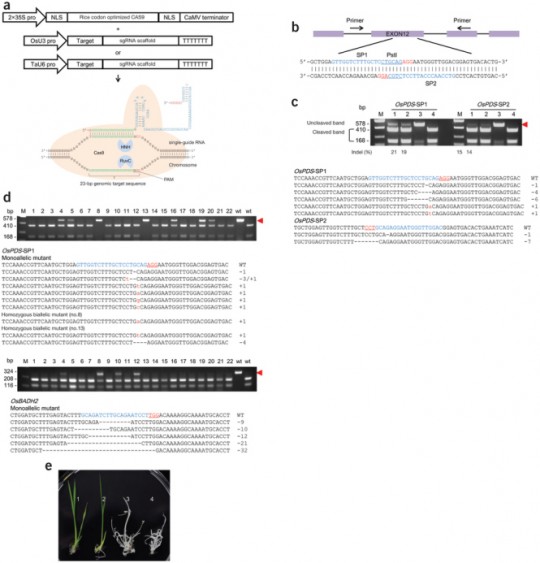
8. 초파리, 제브라피시, 쌀, 애기장대…
셀라인과 쥐라면 다음은 뭐냐?
“이런 연구를 하면 밥이 나오냐 쌀이 나오냐” 하셨던 고갱님. ‘낙아웃 쌀’이 요기잉네요.
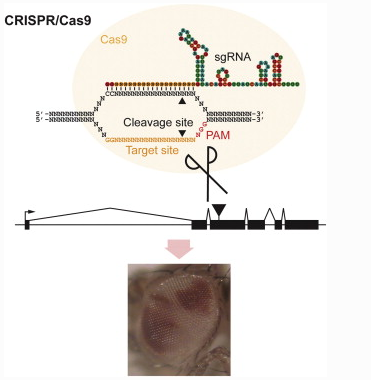
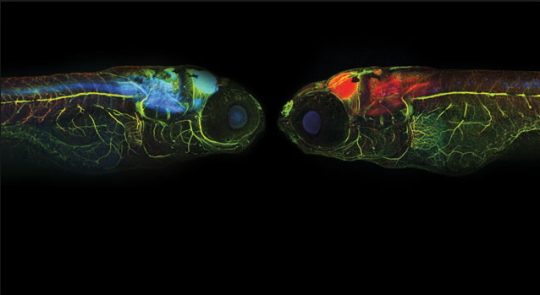

이게 일 년도 안 되서 모두 이루어진 일이다. 분명한 것은 ‘쌀이 나오냐 밥이 나오냐’ 식으로 시작된 연구를 해서 결국 ‘쌀’ 이 나왔다는 것이다.
9. DNA 자르는 것으로 그칠 줄 알았지?
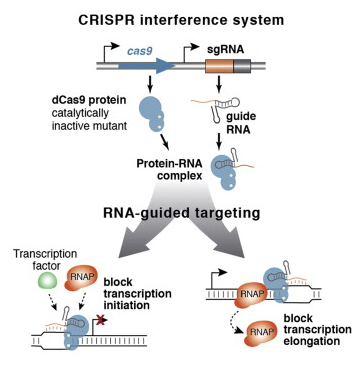
CRISPR/Cas9이 특이적으로 DNA를 자를 수 있다는 특성을 이용해서 ‘DNA는 자르지 않고 지놈 펑션을 연구하는’ 여러 가지 트릭들도 나오기 시작하였다.
DNA를 자르지 못하게 뮤테이션이 들어간 Cas9을 이용하여 Translation을 블락
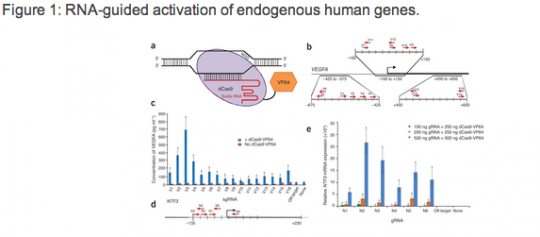
이번에는 유전자에 변형을 하지 않은 상태에서 단지 발현이 잘 안되던 유전자를 Activation
일 년 새에 하도 많은 어플리케이션이 나와서 쫓아가기가 힘들 지경이다. ;;;
10. Editas Medicine : 지놈 수술?
이렇게 불과 일 년 만에 폭풍이 몰아치듯 온갖 생물에 걸쳐서 지놈 에디팅이 기존에 없었던 높은 효율로 가능하다는 것이 보고되고 여러 가지 다른 어플리케이션이 나온 이상 이러한 것이 상업적인 이용이 되지 않을 수가 없었다. 지난 11월 말, George Church, Feng Zhang 등 CRISPR/Cas로 지놈에디팅을 주도한 사람들에 의해서 Startup이 설립되었다. 이름은 Editas Medicine. 초기 자본 4,300만 불.
사실 차세대 시퀀싱 (Next Generation Sequencing) 기술이 보편화되고, 이제 몇천 불이면 개인의 지놈시퀀스를 ‘거의’ 알게 된 시점에 있어서 이 정보를 궁극적으로 활용하는 것은 무엇인가에 대한 회의가 많이 있었다. 가령 이런 기술이 보편화되어 개인당 천 불, 아니 백 불에 시퀀싱을 할 수 있게 된다고 하자. 그래서 시퀀싱을 했더니
“고갱님 시퀀싱 결과를 보니 BRCA1/BRCA2 등등에 아~주 위험한 뮤테이션이 디글거립니다. 님 암 걸리는 거 기정사실임. 마음의 준비를 단단히 하삼.”
…음 그리고 땡?
물론 안젤리카 졸리 눈화처럼 이런 검사결과만을 보고 과감하게 예방적 유방절제술을 받을 만큼 쿨하면서도 용감한 여성분들도 어딘가는 있겠지만, 대개의 경우는 “어쩌라구염?”밖에 할 수 없는 게 사실. 그런데 지금은 아니더라도 이제 지놈을 어떻게든 슥삭슥삭할 수 있다면?
사실 이미 수천억 개의 다세포 생물로 성장해 버린 성인이야 어쩔 수 없다고 손 치더라도, 가령 치명적인 유전자를 물려받을 수도 있는 자식이 ‘세포 하나’(수정란)일 때 이러한 ‘유전자 수술’을 한다면? 분명한 것은 쥐 레벨에서는 지금 이미 이런 것들이 가능해졌다라는 것이고, 쥐 수정란에서 되는 것이라면 사람 수정란에서도 기술적으로 크게 어렵지 않게 가능할 수 있다는 것이다. 문제는 ‘성공률’이겠지만.
여기서 조금 더 나아가면 강남 성형외과의 성형수술을 아예 수정란 단계에서 지놈 레벨에서 해버린다면?
상업적인 것을 떠나서 앞으로 사회적, 윤리적으로 폭발적인 문제가 될 수 있는 판도라의 상자가 열려버린 것은 아닐까?
11. 그러나 시작은 잉여 DNA로부터…
CRISPR/Cas가 불러일으킨 것은 가히 ‘광풍’이라고 표현될 만할 일이었다. 즉, 제한효소/PCR 이래에 생물학의 기본적인 연구방식을 또다시 바꾸어버리는 혁신적인 기술이 나왔다는 것은 그렇다치고, 이 기술이 앞으로 불러올 경제/사회적 파급효과는 지금으로는 상상하기 힘들 것이라고 생각한다.
그러나 여기에 대해서 상상을 펼치는 것은 조금 나중으로 미루어두고, 여기서 이 글을 쓰게 된 동기를 생각해 보자. 이게 다 처음의 “junk DNA인지 뭔지 알 수 없는” 그런 묘한 DNA의 발견으로부터 촉발된 일이라는 것. 중요한 과학적인 발견, 그리고 사회·경제적 효과를 만드는 발견 중 상당수는 이렇게 의도치 않은 우연찮은 발견, 누가 보아도 ‘밥이 나올지 쌀이 나올지 모를’ 그런 연구로부터 시작되었다.
이는 비단 CRISPR/Cas의 예가 최초가 아니다. 사실은 1차 ‘유전공학 광풍’을 몰고 왔던 1970년대의 제한효소의 발견 역시 그 원류는 하찮은 박테리아와 여기에 기생하는 플라스미드라는 DNA 쪼가리에서 나왔다는 것. 진정으로 사회·경제적으로 대박 터지는 연구의 근간은 처음에는 누가 봐도 절대 돈 될 성 싶지 않은 연구에서 나온다는 예를 다시한번 확인시켜 준다.
그러나 사실 기초과학은 이런 ‘잿밥’을 얻기 위해 하는 것일까? 기초과학은 그냥 그저 개인의 호기심을 충족시키기 위해 하는 거다. 그러다가 어쩌다 원치 않은 부수입(?)이 생기면 그걸로 좋은 거고. 파인만 아저씨가 했다고 주장되는 유명한 이야기로 글을 마치고자 한다.
Physics is like sex: sure, it may give some practical results, but that’s not why we do it.
물리학은 섹스와 같다. 가끔 실제적인 결과를 만들어내긴 하지만, 그게 우리가 그걸 하는 목적은 아니다.