전편에서는 영화 이야기를 했으니까 이제 과학 이야기를 할 차례다. 물론 과학사를 들추어보면 무수하게 ‘라쇼몽과 같은 순간’이 있겠지만 그래도 ‘라쇼몽’의 나무꾼처럼 주변에서 직접 목격한 이야기가 좋을 것이므로 지금 이 글을 쓰는 사람이 그래도 근처에서 직접 목격한 이야기를 하도록 하자. 그 전에 공지 하나만. 본인은 아래에서 언급되는 모든 연구 과정에 전혀 참여한 적이 없으며 이 연구에 참여한 연구자들과 현재 아무런 이해관계를 가지고 있지 않음을 미리 밝혀둔다. (그 바닥 뜬지 10년이 넘었거든요.)
어떤 생물이 시스테인을 단백질에 넣는 방법
이것은 단백질의 번역과정에 대한 이야기이다. ‘단백질의 번역과 유전암호는 이미 1960년대에 다 규명된 거 아니야?’ 라고 생각할 사람이라면 정신 차리고 읽어주길 바란다.
일반생물학이나 분자생물학책을 펴 보면 DNA에 코딩된 유전정보가 mRNA를 거쳐 단백질로 번역되기 위해서는 유전암호와 아미노산을 연결시키는 존재가 필요하다는 것을 알 수 있다. 이것이 바로 tRNA(transfer RNA)이며, 20가지의 ‘표준’ 아미노산에 상응하는 tRNA는 각각에 해당하는 짝이 되는 아미노산과 연결이 되며, 이 과정을 촉매하는 것은 아미노아실-tRNA 합성효소(Aminoacyl-tRNA synthetase)라고 한다.
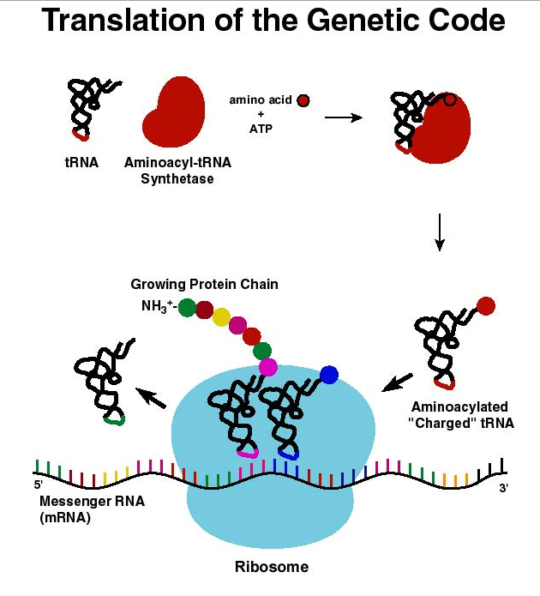
즉 20종류의 아미노산과 연결되어 단백질 합성에 전달하는 tRNA가 있으므로 이들과 아미노산의 연결을 해주는 20가지의 효소가 있다는 이야기이다. 물론 특정한 아미노산에 대한 코돈은 여러 종류가 있긴 하지만 tRNA는 항상 코돈에 상응하는 숫자대로 있는 것은 아니다. 많은 경우에 코돈의 세 번째 염기는 좀 애매하게 작동하는 경우가 있다. 해튼 20종류의 아미노산을 각각 짝이 되는 tRNA에 붙이는 20가지 효소는 특이성이 있어서 제대로 된 tRNA와 아미노산을 구분해 붙임으로써 유전정보가 제대로 전달되도록 한다가 교과서에 나오는 이야기가 되겠다.
물론 사람을 포함한 진핵생물의 세포질, 혹은 대장균과 같은 일부 박테리아(하필 운 좋게도 우리가 분자생물학의 주 모델 시스템으로 사용했던!)에서는 이렇게 교과서에서 기술된 것처럼 20종의 아미노아실 tRNA 합성효소가 존재해 단백질에 사용되는 ‘표준’ 20개의 아미노산을 붙이는 데 사용된다. 그러나 상당히 많은 수의 박테리아와 대개의 (이전에는 ‘고세균’이라고도 하던) 아키아(Archaea)의 경우에는 아미노아실 tRNA 합성효소가 20가지 존재하는 것이 아니라 몇 가지 아미노산에 대해서는 존재하지 않는 경우가 있다.
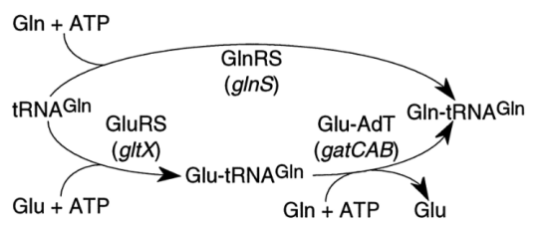
그렇다면 이러한 아미노산은 어떻게 단백질에 들어가게 되는가? 대부분의 박테리아(대장균 등의 극히 일부의 그람 음성세균을 제외)에서 단백질에 사용되는 글루타민은 직접 글루타민이 글루타민 tRNA에 붙어서 들어가는 것이 아니라 일단 글루탐산이 글루타민 tRNA에 붙은 다음 이것이 글루타민-tRNA아미도 전달효소(Glutamyl-tRNAGln amidotransferase)라는 효소에 의해서 글루탐산이 글루타민으로 전환되어 만들어지게 된다. 반면 사람과 같은 진핵생물과 대장균 등의 극히 일부 세균에서는 글루타민 tRNA 합성효소(GlnRS) 에 의해서 직접 tRNA에 붙어서 전달된다.
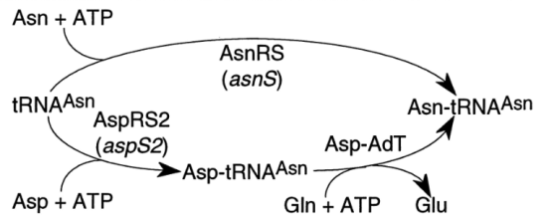
아스파라진의 경우도 상당수의 박테리아와 모든 아키아에서는 동일한 경로로 일단 아스파르트산이 아스파라진 tRNA에 붙은 다음에 아미노기가 전달되며 아스파라진으로 전환되어서 만들어진다.
그래서 상당수의 박테리아, 혹은 아키아에는 20개의 아미노아실 tRNA 합성효소가 있는 것이 아니라 19개, 혹은 18개의 아미노아실 합성효소가 있다는 것은 이미 30년 전에 알려져 있었다. 그런데 이보다 더 심각한 문제는 1996년, 최초의 아키아 지놈인 Methanococcus janaschii의 지놈이 시퀀싱 되면서 생겨났다.

이 미생물의 지놈을 아무리 뒤져봐도 기존에 알려진 아미노아실 tRNA 합성효소에 상응하는 유전자가 고작 16개밖에 존재하지 않았다! 즉 기존에 간접경로로 만들어지는 글루타민과 아스파라진 이외에 라이신, 시스테인을 tRNA에 붙이는 효소에 해당하는 유전자도 지놈 내에서 찾을 수 없었다. 이들 역시 표준적인 유전암호를 사용할 텐데 어떻게 라이신과 시스테인을 단백질에 집어넣는 것일까?
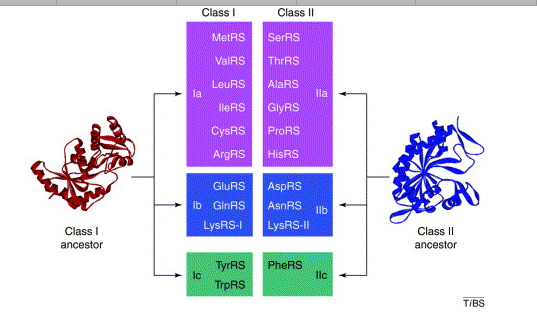
제일 먼저 밝혀진 것은 Methanococcus janaschii 등의 아키아에는 기존의 라이실 tRNA 합성효소 (LysRS)와는 전혀 틀린 LysRS가 존재한다는 것이다. 모든 아미노아실 tRNA 합성효소는 크게 클래스 I과 클래스 II로 구분되는데, 그때까지 알려진 모든 아미노아실 tRNA 합성효소는 종에 상관없이 이 구분이 확실했다. 박테리아에서부터 진핵생물까지 발견된 모든 LysRS는 클래스 II로 구분될 수 있는 효소인데 Methanococcus janaschii는 클래스 II가 아닌 클래스 I로 구분될 수 있는 효소가 있었고, 이의 활성은 생화학적인 단백질 정제와 유전자 클로닝, 그리고 대장균에서의 상보성(complementation)으로 확인되었다.
그렇다면 남은 문제는 어떻게 이 미생물이 시스테인을 합성할 것인가를 밝히는 것이다. 그리해 1990년대 후반에 이 프로젝트가 시작되었는데…
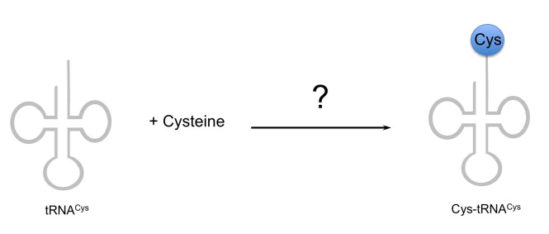
결국 미생물의 전체 지놈 시퀀스가 밝혀졌음에도 시스테인을 단백질에 넣는 경로를 알아내는 데는 별로 보탬이 되지 않았으므로 이를 풀기 위해서 고전적인 생화학 방법론에 의존할 수밖에 없었다. 즉 세포를 왕창 키운 후 이걸 파쇄해서 시스테인을 tRNA에 붙이는 단백질 활성을 따라가서 효소를 정제했다. 그리고 이렇게 정제한 효소의 단백질 서열을 확인해 시스테인을 tRNA에 붙이는 미지의 단백질을 정제한 후, 이의 아미노산 서열을 확인해 봤더니… 프롤린을 tRNA에 붙이는 프롤린-tRNA 합성효소(ProRS) 가 나왔다!
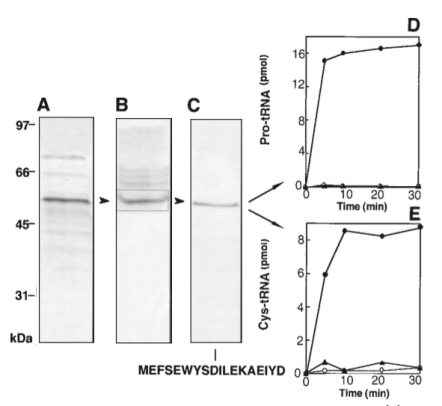
즉 원래 프롤린을 tRNA(Pro)에 붙인다고 알려진 효소가 시스테인도 tRNA(Cys)에 붙인다는 결과이므로 각각 고유한 tRNA에 특이적인 효소가 있다는 종래의 패러다임을 깨는 획기적인 결과였다. 이렇게 해서 논문은 2000년 사이언스에 등장한다. 해당 논문을 낸 포닥은 고국에 (신나서) 교수 자리를 잡아 떠났고 다른 그룹의 연구자들에 의해서도 보고되었다.

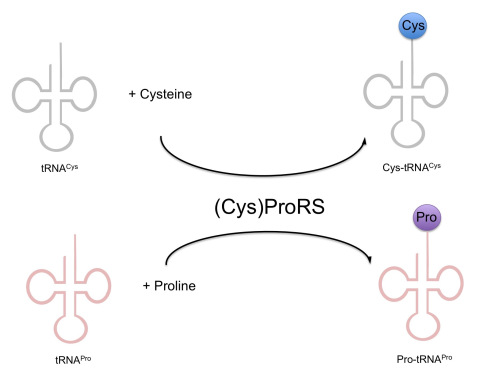
그러나 과연 어떻게 하나의 활성 자리를 가지는 단백질(일부 진핵생물의 경우처럼 두 개의 다른 효소가 하나의 폴리펩타이드에 붙어있는 것이 아니다)이 두 개의 다른 tRNA 합성효소의 활성을 가지게 되는지, 특히 tRNA 합성효소와 같이 기질 특이성이 중요한 효소에서 이러한 일이 어떻게 일어나는지에 대해서는 의문을 가지는 사람들이 적지 않았다.
전혀 다른 CysRS가 존재한다?
그런데 바로 다음 해에 tRNA 업계에서 해당 그룹과 쌍벽을 이루는 (이라고 쓰고 최대의 앙숙이라고 읽는) 다른 그룹에서 이런 논문을 낸다. 내용의 요지는 기존의 클래스 I 및 클래스 II와는 전혀 상동성이 없는 단백질이 CysRS의 활성을 가지며, 아마도 ProRS가 CysRS의 투잡을 뛴다는 것은 사실이 아닐 것으로 추정하는 (그러나 이전의 연구 결과를 반증하는 결과는 없는) 일종의 반박 논문이었다.
그러나 이 결과는 그 후 타 연구실, 혹은 이 연구를 수행한 연구실에서도 일체 재현한 결과가 나오지 않았으며 이 단백질에 대한 후속 연구는 15년이 지난 현재까지도 나오지 않았다(…) 이 단백질을 hhpred와 같은 것으로 구조예측을 해보면 뭔가를 분해하는 효소처럼 나오는데 현재까지 알려진 tRNA synthetase와는 전혀 닮지도 않았다. 그럼 뭐하는 단백질인가. 낸들 아나.
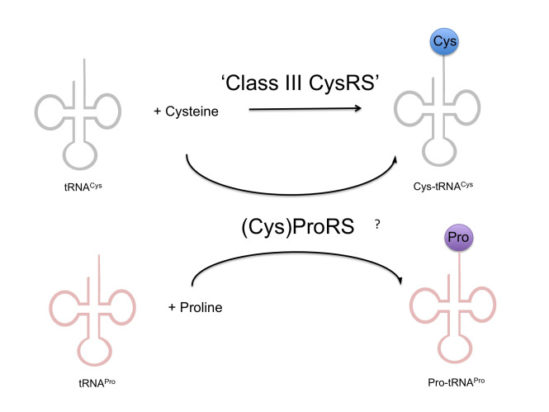
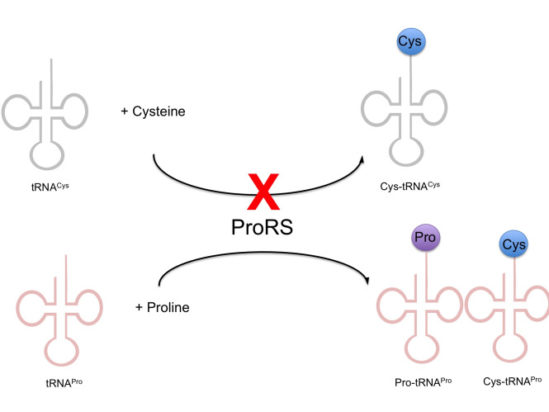
그래서 이전의 ProRS의 실험결과를 재현해서 보다 확실한 메커니즘을 규명하기 위한 후속 연구가 진행되었다. 그러나 해당 연구를 이어서 진행하던 연구자(대학원생)가 매우 놀라운 결과를 발견했다. ProRS가 tRNA에 시스테인을 붙이는 것은 맞지만, tRNA(Cys)에 시스테인을 붙이는 것이 아니라 프롤린이 붙어야 할 tRNA(Pro)에 시스테인을 ‘잘못’ 붙이는, 즉 Cys-tRNA(Pro)를 형성한다는 것이었다!
그리고 Methanococcus janaschii의 ProRS뿐 아니라 대장균을 포함한 세균 대부분의 ProRS는 tRNA(Pro)에 Cys를 붙이는(Mischarging) 활성이 어느 정도 존재한다는 것을 확인했다.
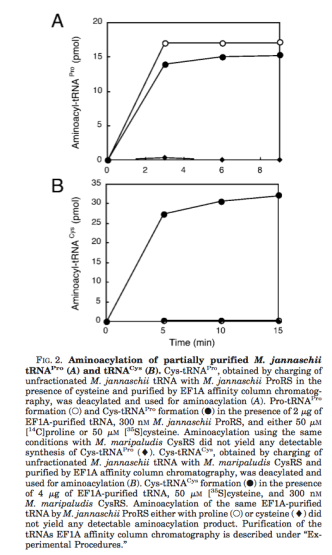
이전의 2000년도 사이언스 논문에서는 기질로 전체 tRNA를 사용했으므로 tRNA(Pro)에 붙는지 tRNA(Cys)에 붙는지 확인할 길이 없었다. 그러나 이 효소는 순수 정제한 tRNA(Pro)를 상대로는 Cys를 붙이지만 tRNA(Cys)를 붙이지 못했다. 그렇다면 tRNA(Pro)에 잘못 들어가는 Cys는 어떻게 처리되는가? 이는 별도의 단백질인 ybaK라는 단백질에 의해서 제거된다는 것이 차후에 발견되었다.
이 결과는 시험관 속에서 반응하는 효소의 ‘에러’에 해당하는 이야기로써, 실제로 단백질 내에 시스테인을 넣는 기전과는 별 상관이 없는 발견인 셈이다. 기존의 결과는 시험관 내에서의 결과를 보다 엄밀한 검증 없이 그대로 믿어버린 데서 나온 오류라고 할 수 있다. 사실 2000년도의 사이언스 논문에도 이 활성이 암시하는 결과가 있었다. 즉 방사능 동위원소로 표지된 시스테인과 함께 동위원소가 표지가 되지 않은 과량의 프롤린을 반응액 속에 넣으면 더 이상 tRNA에 아미노산이 붙지 않는 결과가 나왔다.
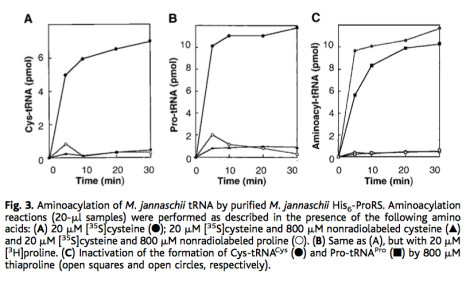
이 단백질이 tRNA(Pro)에 시스테인을 다는 성질을 가진다는 것을 안 시점에서는 이 결과는 과량의 프롤린을 넣으면 Cys-tRNA(Pro) 대신에 Pro-tRNA(Pro)를 만들기 때문에, 동위원소로 표지된 Cys-tRNA(Pro)가 나오지 않는다는 해석이 가능하다.
그러나 이 논문을 낼 당시에는 이 결과를 “프롤린과 시스테인의 효소 활성 위치가 같고, 프롤린이 많이 존재하는 경우 tRNA(Pro)에 Pro를 붙이고, 시스테인이 많이 존재하는 경우에는 tRNA(Cys)에 Cys를 붙이는 이 단백질의 성질을 보여주는 것이다”라고 해석했다. 과연 이 당시에는 정말로 이 효소가 tRNA(Pro)에 Cys를 ‘잘못’ 붙일 수 있지 않을까 하는 가능성에 대해서는 전혀 생각하지 못한 것일까? 그것은 지금으로써는 알 도리가 없다.
다시 처음으로 되돌아가서, 그렇다면 다른 그룹에서 제시된 클래스 I도 아니고 클래스 II도 아닌 ‘CysRS’의 경우는 어떻게 되는가? 이들을 포함해 대장균 뮤턴트에서 in vivo 실험이 수행되었으나 ProRS 역시 대장균의 CysRS 돌연변이주를 회복하지 못했고, 이전에 다른 곳에서 보고된 ‘클래스 III CysRS’ 역시 in vivo에서 활성을 보여주지 못했다. 결국 몇 년간의 노력에도 불구하고 최초의 의문, Methanococcus janaschii에서 어떻게 시스테인을 단백질에 넣느냐에 대한 결론은 나지 않은 상태였다. 즉 수년간의 연구를 진행했지만 결국 아무런 결론이 나지 않는 상황으로 되돌아간 셈이다.
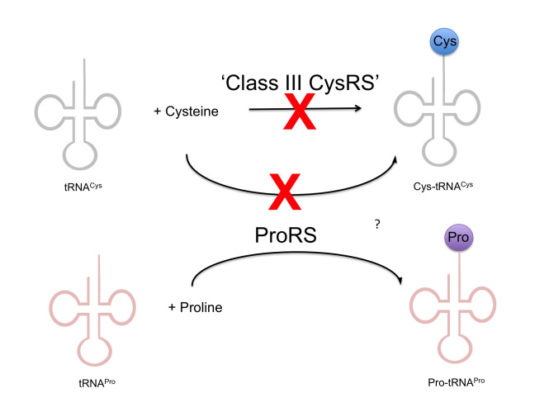
그래서 또 다른 대학원생은 처음부터 Methanococcus janaschii에서 ‘진짜로’ tRNA(Cys)에 시스테인을 붙이는 활성을 찾기 위한 실험에 들어갔다. 다들 쟤 언제 졸업하냐고 걱정했지. 헛된 걱정이 되었지만.
한 걸음이 아닌 두 걸음
일단 기존의 효소 활성을 검출하는 검출법은 tRNA(Pro)에 시스테인을 ‘잘못’ 붙이는 것과 tRNA(Cys)에 시스테인을 ‘제대로’ 붙이는 활성을 구분하지 못한다는 문제점이 있었다. 이를 구분하고자 아미노산이 붙은 tRNA와 그렇지 않은 tRNA를 전기영동을 통해서 분리하고, tRNA(Cys)만을 노던 블랏으로 검출해내는 검출방법을 세팅하고, 효소 활성을 측정했다.
이 결과 세포를 파쇄한 후 초원심분리를 돌려서 얻은 조효소액에서는 tRNA(Cys)에 시스테인을 붙이는 활성이 검출되었다. 그러나 이 조효소액을 후속 정제(이온교환 크로마토그래피)를 하기 위해서 투석(Dialysis)을 수행하자 효소 활성이 없어지는 기이한 현상이 벌어졌다. 결국 효소 활성에 필요한 ‘보조인자’ 가 투석에 의해 빠져나간다는 사실을 알았고, 우여곡절 끝에 이것이 포스포세린(Phosphoserine)과 황화나트륨(Sodium Sulfide)이라는 것을 알았다.
결국 시스테인 합성의 실체는, 처음에 tRNA(Cys)에 인산화세린(Phoshoserine, Sep)을 결합시키는 효소(SepRS)에 의해서 Sep-tRNA(Cys)가 생성되고, 별도의 효소(SepCysRS)에 의해서 인산화세린이 시스테인으로 전환되는 2단계의 과정임을 알게 되었다.
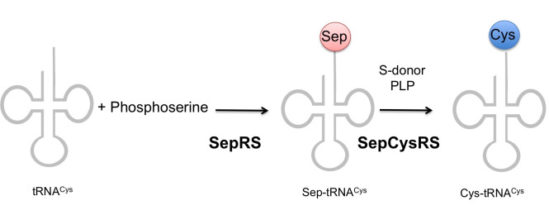
인산화세린을 tRNA에 붙이는 SepRS로 확인된 효소가 어떤 단백질인지 보니 이전에 지놈 시퀀싱이 된 다음 단백질 상동성에 의한 어노테이션(BLAST search 등에 의한)으로는 페닐알라닌을 붙이는 PheRS와 유사하다고 해서 두 번째의 PheRS로 어노테이션된 상태였다는 것이다. 그러나 이 단백질을 발현해 생화학적 활성을 조사해 본 결과 페닐알라닌을 tRNA에 붙이는 활성은 없어서 그냥 ‘pseudogene인가부다’하고 방치되어 있었던 유전자였다.
그렇게도 찾아 헤매던 유전자는 같은 랩의 냉장고에 몇 년 전에 (정체를 확인하지 못한 채) 클로닝 되어 있던 클론이었다는 것이다. 시퀀스 상동성에 의한 단백질의 어노테이션을 너무 신봉하지 말라는 좋은 예가 바로 여기서 나온다(…) 결국 해당하는 합성 경로는 거의 10여 년의 세월을 거쳐, 많은 삽질과 혼선 끝에 밝혀진 셈이다. 이 연구 결과는 이 스토리에 관련되어 발표된 무려 세 번째(…) S or N 논문으로 2005년 사이언스에 발표된다.

의도하지 않은 응용을 낳은 연구
이렇게 그동안의 의문이 풀리고 나니 그다음의 연구들은 큰 무리 없이 흘러갔다. 여기에 관련된 두 개의 단백질, SepRS와 SepCysRS의 구조가 결정되었다. 그리고 인산화세린을 tRNA(Cys)에 붙이는 SepRS를 이용해 중요한 응용이 시도된다. 특이적인 위치에 인산화세린을 넣을 수 있는 단백질 발현시스템이 개발된 것이다. 즉 tRNA와 SepRS, 그리고 aa-tRNA를 전달해주는 연장인자(Elongation Factor)인 EF-Tu를 뜯어고쳐서 일정한 위치에 스톱코돈을 넣고 이 위치에 인산화세린을 넣을 수 있는 단백질 발현 시스템이 개발되었다. 최근에는 이렇게 단백질 안에 삽입된 인산화세린을 화학적으로 변형시켜 임의의 변형된 아미노산을 넣을 수 있는 시스템도 개발되었다.
이러한 응용 자체는 해당 연구가 초창기에 있던 시절, 즉 어떤 생물이 시스테인을 어떻게 단백질에 넣을까와 같은 의문을 가질 때는 미처 상상하기 힘들던 일이다. 결국 기초과학의 발전이 응용으로 이어지는 과정을 예측하는 것은 매우 힘들다는 수많은 예 중의 하나가 될 것이다. 숲속에서 헤매던 10여 년의 세월이 흐르고 비밀이 걷히기 시작한 후에는 빠르게, 비교적 확고한 사실로 규명되어 나가게 되었다.
숲속을 헤쳐나가기 위해 가져야 할 태도
미궁 속에서 서로 엇갈린 정보들로 혼란스러웠던 발견이 점점 진실에 가까워지는 하나의 과정을 살펴보았다. 여기서 기술한 과정은 사실 그렇게 특별한 것은 아니고, 우리가 보는 교과서의 ‘과학적 상식’들 대부분이 발견된 과정에서도 공통적으로 찾아볼 수 있다. 과학 연구의 초창기에는 누구나 ‘라쇼몽’의 등장인물들이 겪었던 것과 같은 ‘라쇼몽 효과’를 경험하게 되는 것이다. 그때의 시행착오나 잘못된 결론은 어쩌면 과학적 발전을 위해서 필수적으로 겪어야 할 통과의례일 수도 있다.
그렇다면 이러한 ‘라쇼몽 상태’에서 비교적 ‘과학적 진실’에 가까운 상태로 발전하기 위해서는 어떤 조건들이 필요할까? 물론 위에서 예를 든 케이스는 비교적 단순한 생화학반응으로 설명되는 것이지만 이보다 훨씬 복잡한 시스템에서 이루어지는 연구의 경우 좀처럼 쉽게 ‘라쇼몽 상태’를 벗어나기 힘든 경우도 많이 있다. 어떤 경우에서는 현재의 연구 방법론과 전혀 다른 연구 방법론이 나와 연구의 패러다임이 완전히 바뀐 다음에야 가능한 경우도 있을 것이다.
그런 기술적인 장벽이 아닌, 현존하는 기술에 의해서 비교적 제대로 된 사실에 근접한 이해가 가능한 상황에서 ‘미궁’을 빠져나가려면 우선 다음과 같은 것들을 생각해 볼 수 있을 것이다.
- 기존의 결과와 이론에 집착하지 않는 생각: 사실 이 프로젝트를 진행할 때만 하더라도 20개의 아미노아실 tRNA 합성효소는 특이성을 가지고 있으며, 결단코 남의 tRNA에 엉뚱한 아미노산을 달지 않는다는 것이 일종의 패러다임처럼 생각되어 왔었다. 그러나 프롤린을 tRNA(Pro)에 달아두는 것으로 생각했던 ProRS가 시스테인과 같은 다른 아미노산도 자신의 tRNA에 달 수 있는 생화학적인 활성이 있다는 것은 여기서 처음 밝혀진 결과이다. 물론 이렇게 아미노산이 잘못 달린 tRNA는 별도의 교정효소에 의해서 교정되는 것이 후에 알려졌지만, 이러한 사실을 모르는 상태에서 tRNA에 시스테인을 달아버리는 활성은 tRNA(Cys) 에 결합시키는 활성이라고 전제해 버렸고, 이러한 전제는 차후의 연구에 큰 혼선을 가져왔다. 기존에 구축된 이론, 특히 도그마화되어 버린 ‘법칙’은 그 법칙 외부의 무엇이 발견될 때 진보를 방해하는 주된 요소가 된다는 것을 알게 된 좋은 계기라고 할 수 있다.
- 특별한 주장은 특별한 증거가 필요: 프롤린을 tRNA(Pro) 에 결합시킬 수 있는 효소가 시스테인을 tRNA(tRNA-Pro인지 tRNA-Cys인지도 확인하지 않은 상태에서)에 결합한다는 생화학적인 결과만을 가지고 너무 빠르게 두 가지 서로 다른 활성을 하나의 활성 자리가 가진 효소가 겸할 수 있다는 매우 특별한(이라고 쓰고 무리수라고 읽는) 주장을 했고, 이것을 정확히 검증하지도 않은 채 결과를 발표하는 바람에 후속의 연구에서 큰 혼선을 낳았다. 적어도 기존의 ‘법칙’에서 발견되지 않은 예외적인 현상을 발견해 이것을 주장하기 위해서는 이를 검증하는 예외적인 증거를 제시해야 하지 않았을까?
- 자기 자신과 자신의 결과 역시 의심: 많은 연구자는 이것이 자신의 손에 의해서 직접 수행된 결과, 혹은 자신의 랩에서 수행된 결과이기 때문에 믿을 수 있다는 선입견, 아니 ‘본능’과 같은 것을 가지고 있다. 실질적으로 자신이 관찰한 것을 믿을 것이냐, 남이 관찰한 것을 믿을 것이냐와 같은 선택의 기로에서 자신의 관찰 대신 타인의 관찰을 더욱 신뢰할 사람은 그리 많지 않을 것이다. 그러나 이러한 인간의 본성을 이해한다고 해도, 잠시 타인의 시선에서 생각해 보는 것은 어떨까? 특히 미궁에 빠진 순간에서는 더더욱 그렇다. 자신이 그렇지 못하다면 제3자의 의견을 들어보도록 하자.
- 인간은 누구나 실수할 수 있다는 것을 인정: 모든 과학 연구 과정은 실수의 연속이라는 것을 인정하는 것이 중요하다. 즉 내가, 혹은 나의 랩에서 낸 이전의 결과라도 충분히 과정적인 실수가 있을 것이며 데이터의 해석이 잘못되었을 수도 있다. 틀린 것은 부끄러운 것이 아니다. 그러나 틀렸다는 것을 알면서도 그것을 인정하지 못하는 아집은 진정한 과학 발전을 가로막는다.
- 이런 조건이 모두 갖추어졌어도 당분간 미궁을 못 빠져나갈 수 있다고 인정하는 태도: 그래서 과학은 어렵다(…) 그런 경우에는 잠시 이 문제를 놓고 다른 문제를 생각해 본다. 지금 풀 수 없는 미궁에 빠진 문제라도 기술의 발전, 혹은 우연한 제3자의 발견으로 실마리가 생길 가능성은 분명히 존재한다. 지금 안 풀리는 문제에 집착해봐야 그 문제를 푸는 데 보탬이 되지 않을 수 있다.
다시 영화로 돌아가서
영화 〈라쇼몽〉으로 다시 돌아가자. ‘라쇼몽’은 헤이안 시대에 시체를 내다 버리는 장소고 거기에 누군가가 어린아이를 유기했다. 나무꾼조차 정직하지 않은 면이 있는 사람임을 알게 되자 승려는 아이를 데려가려는 나무꾼을 제지한다. 그러나 나무꾼은 여섯 아이가 이미 있는데 아이 한둘이 더 있는 것이 무슨 상관이겠냐며 자신이 키운다고 한다. 승려는 여기에 감동해 “인간에 대한 믿음을 지킬 수 있게 해 감사하다”며 나무꾼에게 아기를 내주고 영화는 끝난다.

‘인간은 과연 자신의 이익을 초월해 진실을 말할 수 있는 존재인가’라는 무거운 주제를 다룬 영화지만 인간에 대한 신뢰를 완전히 포기하지는 않은 감독의 시선이 돋보이는 장면이다.
결국 과학도 그러하다. 우리가 아무리 과학의 진실을 탐구하고자 한다고 해도 우리가 접하는 개별적인 관찰은 좀처럼 객관적이고 누구나 다 믿을 수 있는 과학적 진실의 형태로 드러나지는 않는다. 이렇게 본질적으로 어려운 과학 연구가 그나마 조금이라도 수월하게 되기 위해서는 우리는 인간에 대한 믿음, 과학적 진실을 밝힐 수 있다는 믿음을 포기해서는 안 되지 않을까. 그런 의미에서 의도적이고 교묘한 연구부정 행위가 이러한 ‘진실 추구’ 활동에 얼마나 큰 해악을 가져오는지는 굳이 강조하지 않아도 될 것이다.
끝으로 참으로 어리숙한 야매 과학자였던 나에게 과학의 어둡고 밝으면서도 리얼한 여러 면을 동시에 구경시켜준 그 당시의 ‘그때 그 친구’들에게 감사하다는 말로써 이 글을 마치고자 한다. 지금도 야매지만. 근데 님은 이때 이 연구 안 하시고 뭐 하셨어요? 저는 영화봤… 〈라쇼몽〉이랄까, 〈7인의 사무라이〉나 〈동경 이야기〉 등.
