더욱 강한 중력이 필요해!
현대 생물학 실험의 상당 부분은 ‘서로 다양한 성분이 든 혼합물에서 특정한 물질만을 분리하는 것’에 의존한다. 그렇다면 ‘다양한 성분이 든 혼합물’이란 무엇을 말하는가?
일단 혈액을 생각해보자. 혈액은 적혈구, 백혈구, 혈소판 등의 다양한 혈구세포와 액체 성분인 혈장(Plasma)으로 구성되고, 혈장에는 다양한 단백질이 들었다. 세포를 깬 추출물을 생각해보자. 핵이나 미토콘드리아와 같은 다양한 세포 소기관이 있을 것이고, 단백질이나 생체막 등 여러 성질을 가진 성분이 있다. 우유도 성분이 섞인 액체의 좋은 예이다. 유지방 성분이 미셀(michelle)형태로 존재하고 물에 잘 녹는 단백질과 함께 퍼져 있다.
그렇다면 어떻게 이런 성분을 분리할 수 있을까? 액체 안에 무거운 입자와 가벼운 입자가 있다고 생각해보자. 무거운 입자는 빨리 침강해 가라앉을 것이고, 가벼운 입자는 거의 가라앉지 않을 것이다. 막걸리를 생각해보자. 여러 물질이 섞인 막걸리를 가만히 세워두면 입자는 가라앉아 침전한다. 막걸리를 다시 뒤섞어서 막걸리의 성분을 혼합한 다음 입자가 모두 다 가라앉기까지는 매우 오랜 시간이 걸린다. 혹시 이 시간을 단축할 수는 없을까?
막걸리의 입자가 가라앉는 근본적인 힘은 중력이다. 그렇다면 만약 지구에 비해서 중력이 훨씬 센 행성이라면 막걸리 입자는 훨씬 더 짧은 시간 내에 가라앉을 것이다. 우리가 고작 막걸리를 침전시키기 위해서 지구보다 몇 배 중력이 센 행성에 갈 여유는 없겠지만, 인위적으로 ‘중력’을 높일 방법은 없는 것은 아니다. 그렇게 하기 위해서는 원심력을 이용하면 된다.
즉, 특정한 물체가 어떤 중심을 두고 고속으로 회전한다면, 해당하는 물체가 받는 원심력은 다음과 같다.
- 원심력 = 물질의 질량 × 원의 반지름 × (각속도)2
즉 원심력은 물질의 질량이 클수록, 회전 반경이 클수록, 더 빨리 회전할수록 강해진다. 그 이야기는 회전 반경이 크게 회전을 빨리할 수록 물체가 받는 힘은 커지고, 액체 안에 있는 물질은 질량, 반지름, 속도^2 에 비례해 빨리 가라앉는 것이다.
이 원리를 이용해 ‘인위적으로 중력을 높여 지구상의 중력에서는 가라앉는 데 매우 오래 걸리거나 아예 가라앉지 않을 물질을 가라앉히는 것’이 바로 원심 분리의 원리다. 이런 원심분리기(Centrifuge)는 오늘날의 웬만한 생명과학 실험실이건 갖춘 가장 기본적인 실험 기구가 되었다. 요즘의 젊은 과학도들은 ‘센돌이’라고도 부르는 이 실험 기구의 역사를 알아보도록 하자.
원시적인 원심 분리기
그렇다면 언제부터 연구실에 원심분리기가 등장했을까? 파이펫의 등장 과정에서 파이펫의 할아버지 같은 기구가 옷감을 탈색하기 위해 표백제를 넣는 것과 같은 극히 실용적인 용도로 만들어진 것처럼, 원심 분리기의 조상 역시 ‘실용적인 문제’를 해결하기 위한 데서 등장했다.


생크림(Cream)은 우유에 든 지방을 모아서 만들어진 식재료다. 우리가 마시는 일반적인 우유는 균질화(Homogenising)과정을 통해 지방 미셀이 매우 작은 크기로 쪼개져서 크림 층이 나뉘지 않지만, 소에서 갓 채취한 원유는 가만히 놓아두면 우유의 위쪽에 크림 층이 저절로 나누어진다. 아래층의 우유는 탈지우유가 된다. 그렇다면 이런 크림을 더 효과적으로 회수할 수는 없을까?
19세기의 스웨덴의 엔지니어인 구스타프 드 라발(Gustav de laval, 1845-1913)은 액체를 높은 속도로 회전시키면 중력보다 높은 원심력이 가해지고, 이를 이용해 우유에서 크림을 좀 더 효율적으로 분리할 수 있다는 걸 알았다. 그는 이런 원리를 이용해 우유에서 크림을 분리해내는 기계를 만들었다.
간단하게 말해서 우유를 담는 항아리가 있고 손으로 돌릴 수 있는 핸들로 이 항아리를 회전한다. 항아리에 우유를 담고 핸들을 손으로 열심히 돌리면 크림 층은 위로 떠오르고 탈지유는 아래쪽으로 나온다. 이들이 각각 다른 쪽으로 분리되도록 해 한 쪽에서는 크림이, 다른 쪽에서는 탈지유가 나온다!
이렇게 산업계, 특히 식품산업계에서는 원심분리기기의 원리가 일찍 알려졌고, 널리 사용되었지만 학계에서 원심분리기를 본격적으로 사용한 데는 20세기 초반의 한 스웨덴 과학자의 영향이 크다. 이 사람은 테오도르 스베드버그(Theodor Svedberg, 1884-1971)라고 한다.
센돌이로 N모상을 받은 사나이

테오도르 스베드버그라는 사람은 원래 콜로이드 화학(Colloid Chemistry)을 전공한 사람이다. 그런데 콜로이드란 무엇인가? 콜로이드는 10-5㎝에서 10-7㎝ 정도 직경을 가진 비교적 큰 입자가 용매에 퍼져 있는 용액으로 교질(膠質)이라는 표현을 쓰기도 한다. 이 사람은 액체에 녹아 있는 콜로이드 입자의 질량을 알아낼 방법이 없을까 하는 생각을 했다.
그런데 앞에서 말한 것처럼 입자가 침강하는 속도는 입자의 질량에 비례하고, 중력보다 높은 원심력을 얻기 위해서 회전하는 물체에 콜로이드 용액을 넣으면 입자는 침강할 것이고 그 침강속도는 질량과 관계있을 것이다. 그런데 그것을 어떻게 측정할 수 있을까? 그래서 이 사람은 최초의 분석용 초원심분리기(Analytical Ultracentrifuge)를 만들었다.
로터에 콜로이드 샘플을 넣고, 매우 빠른 속도(분당 4만 2,000회전, rpm: rotation per minite)로 돌린다. 콜로이드 용액에 들어있는 입자의 질량이 클수록 좀 더 빨리 침강될 것이고 시간에 따라서 점점 침강이 진행될 것이다. 사실 우유의 유지방 미셀과 같이 매우 덩치가 큰 덩어리는 손으로 돌릴 수 있는 분당 수백 회전 정도로도 충분히 침강했다. 그러나 입자가 작아질수록 침강되는 속도는 느려질 것이며, 생체고분자는 매우 느리게 침강할 것이다.
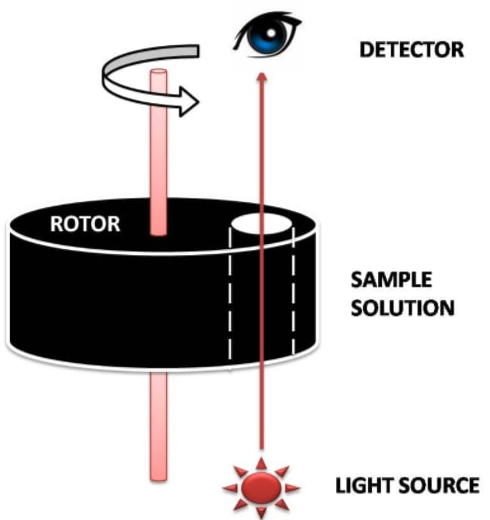
저 위 그림에서 빨간색이 콜로이드 입자라면 처음에는 퍼져 있던 입자가 계속 시간에 따라서 침강될 것이다. 빛을 통해서 흡광도를 측정하면 특정한 시간대에서 입자가 퍼져있는 위치를 알 수 있을 것이고, 시간이 지날수록 위의 프로파일에서 중력가속도가 가해지는 방향으로 커브가 이동하는 것을 알 수 있을 것이다.
스베드버그는 이렇게 매우 빠른 속도로 원심분리를 함으로써, 지구 중력의 수십만 배에 달하는 원심력을 얻을 수 있었고, 지구 중력 하에서는 절대 침강하지 않을 작은 질량을 가진 입자도 침강시킬 수 있다는 것을 확인했다.
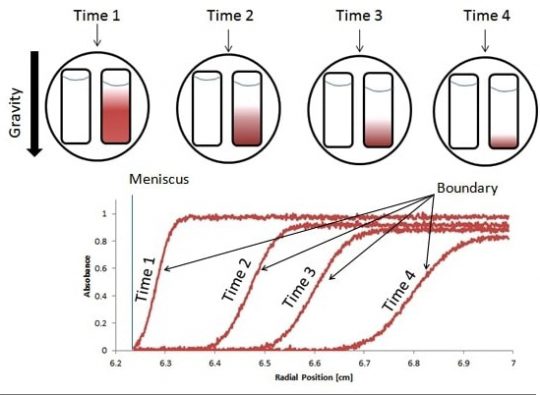
그는 입자의 질량에 따라서 침강하는 속도가 달라진다는 것을 확인했으며, 이렇게 각각 다른 입자가 가지는 고유 침강 성질을 침강계수(Sedimentation coefficient)로 표현했다. 침강계수는 침강 속도를 침강 가속도(원심분리기의 회전 반경과 각속도로 표현되는)로 나눈 숫자이며, 이 단위는 스베드버그의 이름을 따서 S로 불린다.
1S는 10^-13초로 정의되며, 질량이 큰 입자일수록 큰 수치를 가진다. 가령 생물에서 단백질을 만드는 거대한 생체 고분자인 리보솜(Ribosome)의 침강 계수는 70S이며, 리보솜은 두 개의 덩어리로 나뉘는데 큰 덩어리의 침강 계수는 50S, 작은 덩어리는 30S이다.
스베드버그는 이미 분자량을 아는 화학 물질의 침강 계수를 계산했고, 이를 이용해 혈액 중의 헤모글로빈(Hemoglobin)이나 우유의 카세인(Casein) 같은 단백질의 분자량을 최초로 측정했다. 단백질의 분자량이 그때까지 알려진 소분자 물질처럼 1,000 이하보다 수십 배가 큰 수만에 달한다는 것을 안 것도 결국 스베드버그의 원심분리기의 덕이다. 이런 공로로 스베드버그는 1926년 노벨 화학상을 수상했다.
원심 분리를 이용한 시료의 분리
스베드버그가 초원심분리(Ultracentrifuge)를 만들어서 입자의 질량을 추정했지만, 그것은 시료의 성질을 파악하는 분석기기의 차원이었고, 오늘날 원심분리기에서 흔히 기대되는 서로 다른 질량을 가진 샘플을 분리하기 위함이 아니었다. 오늘날 샘플을 분리하기 위해 사용되는 원심분리기(Preparative Centrifuge)는 분석용 원심분리기가 개발된 1920년대 이후에 출현했다.
이런 원심분리기의 개발로 인해서 기존에 생각하지 못하던 발견이 이루어지는데 이것은 미토콘드리아, ER, 라이소솜(Lysosome) 등 세포 안에 여러 생체막으로 둘러싸인 구성성분이 존재한다는 것이다.
알베르 클로드(Albert Claude, 1899-1983)는 벨기에 출신의 생물학자로 1929년 미국의 록펠러 의학연구소(지금의 록펠러 대학)에서 세포에 대한 연구를 시작했다. 사실 많은 과학 발견과 마찬가지로 클로드의 원래 연구 목적은 세포의 구성 성분이 어떻게 되어 있느냐가 아니라 암을 유발한다고 알려진 바이러스가 세포 내에서 어떻게 존재하는지 그 화학적인 실체를 밝히는 것이었다.

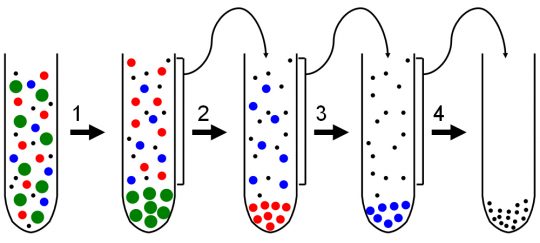
바이러스이건 무엇이건 세포 안의 물질을 분석하기 위해서는 세포를 파쇄해 세포 내의 구성물을 꺼내야 한다. 그렇다면 어떻게 세포를 부수는가? 클로드는 고기 그라인더(Meat Grinder)로 세포를 갈아서 세포가 가진 성분들을 액체 상태로 만들었다. 그다음 저속으로 원심분리를 돌려서(1,500xg, 지구 중력의 1,500배에 해당하는 원심력) 아직 깨지지 않은 세포와 세포핵(nucleus)를 침전시켰다.
아직 침전되지 않은 ‘국물’을 가지고 이번에는 좀 더 높은 속도인 중력 대비 2,000배에 해당하는 원심력으로 원심분리기를 돌렸다. 그러자 이전에 1,500xg에서 아직 침전되지 않은 세포 내의 좀 더 작은 물질들이 침전되었다. 그는 여기서 얻은 ‘국물’로 1만 8,000xg의 원심력이 적용되는 훨씬 더 빠른 속도로 원심분리기를 돌려서 침전물을 얻었다. 즉,
- 1,500xg에서 침전되는 매우 큰 덩치의 물질: 깨지지 않은 세포 및 세포핵
- 2,000xg에서 침전되는 조금 작은 입자: 세포 소기관
- 1만 8,000xg에서 침전되는 좀 더 작은 입자: 더 작은 세포 구성물
- 1만 8,000xg에서도 침전되지 않는 물질: 단백질 등
이렇게 원심분리 속도에 따라서 세포 내의 물질을 부피(=질량)에 따라서 분리할 수 있게 된 것이다. 그리고 이렇게 침전된 물질을 어떤 조성을 가진 액체로 녹여내느냐에 따라서 서로 다른 성질을 가진 세포 내의 구성성분을 추가적으로 분리할 수 있었다.
이런 식으로 미토콘드리아, ER, 라이소솜 등의 세포 구성물을 최초로 분리했고, 이렇게 원심분리 속도에 따라서 다른 세포 구성성분을 분리하는 기술을 분별 원심분리(Differential Centrifuge)라고 부른다. 이런 분별 원심분리는 세포의 구성물을 가능케 해 세포가 단순히 물질이 균질하게 섞인 ‘가죽 백’ 이 아니라 정교한 부품으로 구성된 복잡한 구성물이라는 것을 이해하게 해주는 기술이 된 셈이다.
알베르 클로드는 1974년 다른 두 명의 과학자들과 세포 내의 구조물을 최초로 분리하고, 이를 확인했다는 공로로 노벨 생리의학상을 탄다. 요즘 연구자들은 실험실의 필수 요소라고만 생각하는 그 ‘센돌이’ 덕에 벌써 두 명이 노벨상을 탔다는 것은 놀랍지 아니한가!
초원심분리의 보급과 전성시대
일단 스베드버그가 만든 분석용 초원심분리기는 어마어마한 덩치를 가진 실험 장비라기보다는 ‘실험 시설’ 에 해당하는 것이었고, 원심분리기가 실험실에서 대중화되기 위해서는 일반적인 실험실에서 작동할 만큼 소형화되어야 했다.
버지니아 대학의 연구자인 에드워드 피켈은 고속으로 돌아가는 원심분리기, 특히 초원심분리기와 같이 1분에 수만 번이 돌아가는 기구에서 공기에 의한 마찰이 에너지를 소모하고, 열을 발생시킨다는 것을 깨달았다. 그렇다면 이를 해결하기 위해서는… 원심분리기에서 실제로 회전하는 부분이 있는 챔버를 진공 상태로 유지하면 공기에 의한 마찰이 줄어들 것이므로 훨씬 덜 에너지를 소모하면서 고속 회전을 가능하게 할 것이다.
피켈은 1940년대에 자신의 발견을 상업화하기 위해 스핀코(SPINCO)라는 회사를 설립해 1940년 최초의 개인 연구실에 비치할 만한 크기의 초원심분리기를 개발했으며, 스핀코는 1950년대에 베크만(Beckman)사에 인수되어 초원심분리기가 연구실에 보급된다.
이제 실험실에 비치할 수준의 초원심분리기가 보급된 것은 생명과학, 특히 분자생물학의 발전에 엄청난 영향을 미쳤다. 요즘 연구자들은 잘 인식하지 못할 수도 있지만 우리가 아는 수많은 세포와 분자생물학적 발견은 초원심분리기가 없었으면 가능하지 못했다. 그중 대표적인 게 ‘DNA의 반보존적 복제(Semiconservative replication of DNA)’이다. 고등학교 생명과학 교과서에도 나와 있는 유명한 실험이지만 한번 다시 알아보도록 하자.
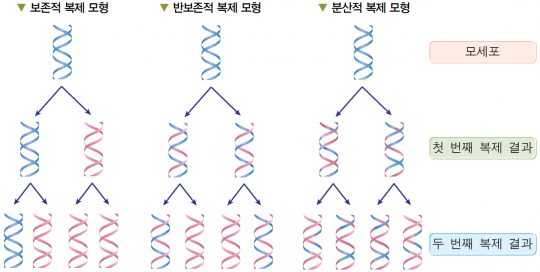
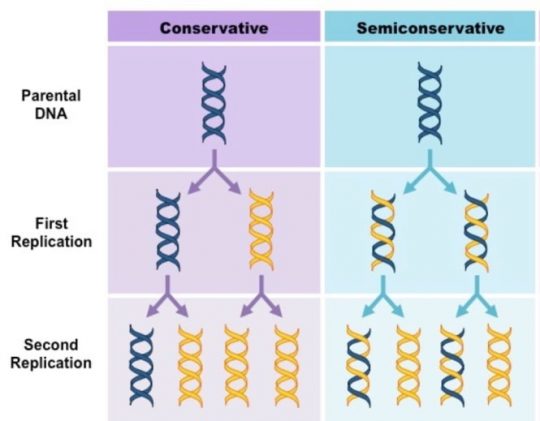
생명의 설계도를 담은 DNA는 이중나선으로 되어 있다. 세포가 증식할 때는 DNA의 복제가 이루어져서 정확하게 그 내용이 두 딸 세포에 분배되어야 한다. 그런데 이의 복제는 어떻게 일어나는가? DNA의 이중나선 모델이 제창된 1950년대 이후에 DNA가 복제되는 방식에 여러 모델이 있어 왔다.
첫 번째는 이중나선이 풀리지 않은 채로 복제되는 경우이다. 이 경우에는 ‘보존적 복제(Conservative replication)’라고 하며, 최초의 부모가 가진 DNA는 항상 간직되고 이에 대한 정확한 복제가 생기는 것이다. 반보전적 복제(Semiconservative replication)은 DNA의 이중 나선이 풀려서, 각각의 가닥을 주형으로 새로운 DNA 가닥이 생기는 것이다.
지금은 당연히 후자라는 것이 ‘교과서에 나와 있으므로’ 모든 사람이 상식으로 받아들이지만, DNA라는 것이 유전 물질이라는 것이 처음 밝혀지는 시점에서는 그렇지 못했다. 어떻게 두 가닥의 DNA 이중나선이 풀리고, 각각의 나선을 주형으로 DNA가 합성된다는 것을 밝힐 수 있을까? 그렇다면 원래의 DNA를 절반씩 주형으로 해 DNA가 합성되는 것을 증명하기 위해서는 어떻게 해야 할까?
메셀슨과 스탈은 대장균 DNA의 복제 과정을 추적해 이를 증명하려고 했다. 일단 기존에 합성된 DNA와 새롭게 합성된 DNA를 서로 ‘구분’ 하기 위해 그들은 대장균을 일단 동위원소 질소(정상적인 원자량인 14가 아닌 원자량이 15인 질소, 15N)가 함유된 배지에 키워서 DNA를 모두 ‘무거운’ DNA로 대치했다. 그리고 이렇게 ‘무거운 DNA’를 가진 대장균을 정상적인 질소(원자량이 14인 질소, 14N)가 함유된 배지에서 키우면 새롭게 합성된 DNA는 ‘가벼운’ DNA를 가진다.
만약 DNA의 이중 나선이 각각 새로운 DNA의 주형이 된다면, 그림에서 보는 것처럼 DNA 중에는 기존의 ‘무거운 가닥’과 ‘가벼운 가닥’이 같이 하나씩 존재하는, 중간 무게를 가진 것이 있을 것이고, 그 비율은 점점 세대가 지날수록 감소할 것이다. 그러나 DNA의 이중 나선이 풀리지 않고 복제되는 ‘보존적 복제’에서는 ‘무거운 가닥’과 ‘가벼운 가닥’을 동시에 가진 것은 없고 ‘무거운’ DNA와 ‘가벼운’ DNA만 존재할 것이다.
그렇다면 ‘무거운’ DNA와 ‘가벼운’ DNA를 어떻게 구분하는가? DNA의 질소를 15N으로 모두 치환한다고 해봐야 이는 그리 큰 무게의 차이는 아니다. 어차피 동위 원소가 들어간 DNA이건 그렇지 않은 DNA이건 대장균의 DNA 길이는 같으므로, 무게 자체에서는 큰 차이는 나지 않을 것이다. 따라서 단순한 침강 계수의 차이만으로 DNA의 무게 차이를 구하는 것은 어렵다. 그렇지만 이 두 물질 간의 밀도의 차이는 상당할 것이다. 이를 위해서 이들은 밀도 구배 원심분리(Density-gradient centrifugation)라는 것을 사용했다.
이의 원리는 대략적으로 이렇다. 염화세슘(CsCl)은 분자량이 168.36에 달하는 물질로 소금(Sodium chloride) 등에 비해서 매우 무거운 물질이다. 약 6M 정도가 되는 높은 농도의 염화세슘 용액을 약 20만 xg(중력의 20만 배, 로터에 따라 다르지만 분당 4-5만 회)정도로 돌리면 무거운 세슘 이온은 원심력이 작용하는 바깥쪽으로 침강할 것이고, 따라서 바깥쪽으로부터 안쪽으로 (튜브 아래쪽부터 위까지) 더 높은 세슘 이온 농도에서 낮은 농도로의 농도 구배(Gradient)가 생길 것이다.
DNA 같은 고분자 물질 역시 침강할 것이다. 그러나 세슘 이온과 같은 것들이 침강하면서 점점 더 높은 농도로 존재한다면 저항을 받을 것이고, 점점 증가하는 세슘의 밀도와 DNA의 밀도가 같은 지점에서 침강을 멈추게 될 것이다. 이런 원리를 이용해 15N 이 들어간 ‘무거운 DNA’와 14N을 가지는 ‘가벼운 DNA’, 그리고 15N과 14N이 반반으로 구성된 ‘한쪽은 무거운 DNA 가닥, 다른 쪽은 가벼운 DNA 가닥’으로 이루어진 DNA를 각각 밴드 형태로 구분할 수 있는 것이다.
만약 반보존적 복제 기작이 맞다면 ’15N과 14N 밴드 사이에 다른 밴드가 보일 것이고, 그렇지 않으면 보이지 않을 것이다. 메셀슨과 스탈은 이 실험 기법을 이용해 15N과 14N으로 반반 구성된 DNA가 존재한다는 것을 보였고, DNA는 반보전적으로 복제된다는 것을 알았다. 결국 DNA의 이중 나선 구조와 함께 왓슨과 크릭이 주장했던 DNA의 이중 나선에 의한 복제 기작 역시 초원심분리기 덕에 확증된 것이다.
이런 세슘 밀도 구배 원심분리는 이 연구뿐 아니라 수많은 생체 고분자의 분리에 응용되었다. 뒤에 DNA의 분리 과정에서도 자세히 설명하겠지만, 덩치가 큰 염색체 DNA와 그 외에 들어 있는 자그마한 DNA인 플라스미드(Plasmids)를 분리하는 것도 맨 처음에는 초원심분리를 통해 이루어졌다. 그리고 수많은 바이러스를 순수 정제하는 데도 원심분리기는 필수적이었다.
밀도 구배 원심분리기와 초원심분리기는 여러 단백질 복합체나 세포 소기관, 혹은 리보솜 등을 분리하는 데도 이용되었다. 앞에서도 설명했지만 우리가 리보솜 두 덩어리가 합쳐진 것을 70S(진핵생물에서 80S), 큰 덩어리를 50S, 작은 덩어리를 30S라고 부르는 것 자체가 리보솜을 초원심분리를 이용해 분리할 때 리보솜의 침강 계수에 의해서 유래된 이름이다.
초원심분리기로 쉽게 분리되는 생체고분자의 하나가 세포 내에서 세포골격의 하나인 마이크로필라멘트(microfilaments)를 형성하는 단백질인 액틴 필라멘트이다. 액틴 자체는 42kDa(분자량 4만 2,000)정도의 단백질이지만, 이 단백질은 여러 개의 액틴 필라멘트와 결합해 매우 긴 필라멘트를 형성한다.
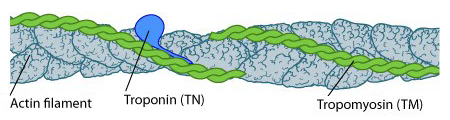
어떻게 세포 중에서 액틴을 순수히 분리할 수 있을까? 액틴은 어느 정도 농도가 높아지고, 염 용액 상태에서 필라멘트를 형성하는 경향이 있다. 이렇게 형성된 필라멘트는 수백·수천 개 이상의 단량체가 결합된 초거대 고분자기 때문에 초원심분리기로 3만 xg 정도의 원심력으로 돌려주면 쉽게 침강되어 침전물, 즉 펠렛(Pellet)을 형성한다. 이렇게 얻은 침전물에는 액틴과 함께 몇 종류의 액틴에 결합하는 단백질이 같이 붙어 있을 것이다.
여기서 순수한 액틴만을 얻어내려면 어떻게 할까? 침전물을 저염 용액 상태에서 녹여주면, 액틴은 필라멘트를 형성하지 못하고 대부분 단량체로 해리된다. 이것을 다시 초원심분리기로 돌려주어, 이번에는 상층액만을 취해주면 필라멘트 형태로 남아있는 소수의 액틴과 액틴에 붙어있는 단백질, 그리고 소수의 초고분자 단백질 등은 펠렛에 남아 있을 것이므로 이제 순수한 액틴만을 얻을 수 있다.
이렇게 원심분리기는 DNA와 RNA, 액틴과 같은 고분자 생체물질을 분리하는 목적으로도 사용되었을 뿐만 아니라 그 성질을 파악하는 데도 중요한 수단으로 사용되었다. 물론 전기영동(Electrophoresis)이 생체 고분자의 성질을 파악하는 중요한 수단으로 사용되기 시작한 1960년대 말과 1970년대 말 사이에는 분석 기기로써 원심분리기의 역할은 이전보다는 많이 줄어들긴 했지만 여전히 원심 분리기는 중요한 생체 고분자를 분리하는 데 필수적인 도구로 이용된다.
에펜돌프 튜브와 탁상용 미니 원심분리기의 등장
이전 파이펫을 다룰 때 우리는 에펜돌프사가 세계 최초의 마이크로파이펫을 개발했지만, 볼륨을 조정할 수 있는 파이펫은 길슨에 뒤늦어서 마이크로파이펫을 처음 개발해 두고도, 마이크로파이펫의 대명사로써의 위치는 길슨 사에 양보하게 되었다는 이야기를 했다.
그러나 에펜돌프 사는 마이크로파이펫 이외에 오늘날의 생물학 연구에 절대 필요불가결한 시스템을 구축하고 상용화했는데, 그것은 1.7㎖ 용량의 플라스틱으로 된 원심분리 튜브, 흔히 말하는 ‘에펜돌프 튜브’(Eppendorp Tube, E-Tube)와 이를 원심분리할 수 있는 탁상용 원심분리기이다.
그전까지 생화학/생명과학 실험에 사용하던 작은 용량의 액체는 당연히 유리 시험관에 담겨져 있었다. 이것을 옮기는 것은 당연히 마우스 파이펫이나 파스퇴르 파이펫을 이용했을 것이고, 그 속도 역시 엄청나게 느렸고, 그러나 신속하게 1㎖ 이하의 적은 용량의 액체를 이동하는 것이 마이크로파이펫의 등장 이후 동시에 많은 샘플에 대한 실험이 가능해졌고, 이를 좀 더 편하게 할 수 있는 작은 용량의 1회용 튜브와 이것을 원심분리할 수 있는 탁상용 원심분리기가 개발되었다.
1963년, 최초의 에펜돌프 튜브인 ‘3810’ 모델이 등장했다. 지금 생각하면 참 당연한 일이지만, 이런 시스템은 기존에 유리시험관에 든 시료를 마우스 파이펫으로 입으로 빨아서 실험을 하던 연구자들에게 엄청난 편의를 가져온다. 특히 분자생물학의 도래와 더불어 1㎖ 이하의 소량의 시료를 가지고 실험이 보편화된 원동력은 이런 1㎖ 이하의 시료를 효율적으로 다룰 수 있는 실험기구들의 등장에 있다고 할 수 있을 것이다.
실험실의 필수 장비가 된 원심분리기
이렇게 원심분리기는 현대 실험 생물학 연구실에 필수 불가결한 장비가 된다. 그러나 그 역사에서 보듯이 원심분리기가 실험실의 필수 장비로 합류한 것은 채 50여 년이 되지 않는다. 어떻게 보면 연구실에서 실제로 실험을 하는 연구자들에게는 더 없이 익숙한 장비나 과학자가 아닌 일반인에게는 그닥 익숙하지 않은, ‘인지도에서의 갭’이 현격한 장비가 아마 원심분리기일지도 모른다.
‘스테레오 타입의 과학자’가 (주로 색이 나는 지시약이 든) 플라스크를 흔들거나 현미경을 들여다보거나 파이펫을 사용하는 척(?)하는 연출 사진은 매스미디어에 많이 등장하지만 원심분리기를 사용하는 장면은 한 번도 본 적이 없다. 영원히 조연에 머무르는 원심분리기… 다시는 원심분리기를 무시하지 마라.
