Cas9 이야기와 Deja vu
최근 바이오 관련 소식 중에서 가장 핫한 이슈라고 한다면 뭐니뭐니해도 CRISPR/Cas9 과 Genome editing 소식이다. 각종 생물의 지놈(유전체)를 떡 주무르듯 조작하는 시대가 와서 형질이 개선된 농작물이나 가축이 등장하고, 불치의 유전병을 치료할 수 있는 수단이 등장하는가 하면, 일부에서는 ‘개선된 인간’, 즉 특정한 형질이 강화된 ‘슈퍼인간’의 출현도 가능한 것이 아닌가 하는, 지금으로 봐서는 우물 파기도 전에 숭늉 찾는 이야기를 하는 분들도 간혹 눈에 띈다.
아직은 공상과학 소설의 도메인에 속하는 이야기가 아니더라도, CRISPR/Cas9에 의한 Genome Editing에 대한 특허분쟁 소식, 해당 기술을 가진 회사가 IPO를 했다는 소식, 혹은 이를 이용하여 면역 항암 치료 (CAR-T등을 위시한) 의 효율을 높였다는 이야기 등이 들려온다. 앞으로 어떻게 발전할지는 모르지만 수많은 화제를 낳고 있는 것은 분명하다. 응용은 둘째치고라도 지금 당장으로서는 이 기술이 생명과학연구에 있어서 하나의 혁신을 이루고 있다는 점은 부인하기 힘들 것이다.
즉 기존의 방법으로는 유전체에 대한 특별한 조작방법이 없던 대개의 생물에 대해서 유전체 시퀀스만 있으면 역유전학 (Reverse genetics)이 가능해진 상황인 것이다. 기존의 모델생물에 의존한 생물학의 지형도를 바꿀 수 있는 포텐셜이 있다 하겠다.
….그런데 이런 CRISPR/Cas9 이야기를 듣다 보면 뭔가 데자뷰 같은 느낌이 드는 사람, 안 계신가? 아마 이런 데자뷰를 경험하기 위해서는 적어도 연구의 연식이 꽤나 된 (…강제연식인증) 분이어야 할 것이다. 즉, 이러한 이야기들은 이미 1970년-80년대 ‘1세대 생명공학기술’ 인 ‘재조합 DNA 기술’이 등장할 때 한 번씩 해 본 이야기였다!
1세대 생명공학 기술이 유전자 한두 개를 분리해서 이를 가지고 깨작거리는, 지금으로 봐서는 극히 초보적인 기술이었음에도 불구하고 1970년대 중후반에 이것이 도입되었을 때는 많은 이들의 우려를 불러일으켰다. 1975년에 미국의 아실로마에서 유전공학기술의 위험성에 대해서 여러 학계인사와 매스미디어, 윤리학자 등이 모여 회의를 하였으며, 유전공학기술의 위험성이 확인되기 전까지는 암 바이러스 등과 같은 위험한 생물에 대한 유전자 조작은 삼가자라는 모라토리움 선언이 있었다. 아실로마 컨퍼런스라는 것을 검색해 보면 나오는 국문 자료라는 게 누군가가 오래전에 올린 자료 정도라는 게 함정
또한 재조합 DNA 기술을 개발한 일원인 UCSF의 허버트 보이어와 벤처기업가 로버트 스완슨에 의해서 최초의 바이오텍 기업인 제넨테크(Genetech) 가 설립되었으며, 의학용 목적의 재조합 단백질의 생산이 이루어지게 되었다. 한편 국내에서는 한참 뒤늦은 80년대 초반부터 ‘유전공학’의 열풍이 일었으며 정작 유전자 조작기술과는 별로 관련도 없는 ‘포마토’ (땅에는 감자가 열리고 위에는 토마토가 열린다는) 와 같은 공상과학기술이 유전공학의 향후 대표산물로 선전되는 해프닝도 있었다. 이 글도 찾아보니 누군가가 오래전에 올린 자료 외에는 별것 없다는 게 함정
여튼 현재 CRISPR/Cas9을 둘러싸고 벌어지는 여러 가지 일들을 보면 1970년대 유전공학 기술의 초창기에 벌어지던 여러 가지 일을 연상하지 않을 수 없다. 그렇다면 1970년대 유전공학 기술이 어떻게 성립되었고, 이것의 상업화는 어떻게 일어났으며 이것의 파급효과는 어떻게 생명과학과 산업계, 그리고 사회에 영향을 미쳤는지를 알아보는 것은 Cas9과 같은 신기술이 앞으로 어떤 과정을 통해서 생명과학계와 관련산업에 영향을 미칠지를 예견하는 좋은 역사적 사례가 되지 않을까?
그런 의미에서 뭔가 쓰고 싶지만 (…) 이미 아주 좋은 연구서가 그것도 국내 연구자에 의해서 출간되었기에 이 책의 내용에 대한 간략한 요약 비슷한 것을 해보도록 한다.
The Recombinant University

현재 서울대 서양사학과 및 과학기술학 연계 전공에 소속된 이두갑 교수의 박사학위 논문 및 기타 연구논문을 기반으로 한 책이다. 1970년대 유전공학 기술의 기반 연구가 수행되었던 스탠포드 대학의 생화학과를 중심으로 한 유전공학 연구가 발생하게 된 그 기반과, 순수기초연구에 기반한 연구의 상업적 이용, 그리고 이렇게 상업화된 연구가 아카데믹 연구기반에 미치는 영향 등을 기술한 학술서이다.
흔히 1970년대 유전공학 기술의 도래는 스탠리 코헨 (Stanley Cohen)과 허버트 보이어 (Herbert Boyer) 간의 협동 연구와 그 이후 허버트 보이어와 로버트 스완슨 (Robert A Swanson)에 의한 제넨테크(Genetech) 의 설립 등에 촛점을 맞추어 기술되었던 것이 사실이다. 그러나 이 책에서는 유전공학 기술의 근간과 이의 상업화는 사실 이러한 소수 과학자와 기업가에 의했다기보다는 스탠포드대학의 생화학과를 중심으로 모인 일련의 연구자 집단의 ‘커뮤니티’에 의한 일종의 ‘집단창작’이라는 것을 강조하고 있다.


니네 3명이서만 유전공학 기술을 만든게 아니라 이거야
아서 콘버그와 스탠포드 생화학과
이 책은 총 6장으로 나누어져 있는데, 첫 장에서는 스탠포드 생화학과를 ‘창시’ 한 DNA 복제 효소의 발견자 아서 콘버그와 그가 어떻게 스탠포드대학의 생화학과를 ‘창시’했는지에 대한 이야기이다. 아서 콘버그에 대해서는 이전에 이런 글을 쓰기도 했다. 사실 이 책의 이 부분은 한국과학사회지에 『아서 콘버그(Arthur Kornberg)의 DNA 연구 제도화와 공동체적 구조의 건설』이라는 논문으로 요약·번역되어 있으므로 보다 자세한 내용은 여기를 참조하기 바란다.
여튼 1950년대 말 미쿡이 NIH를 통하여 의과학 쪽 연구비에 show me the money를 치고 있을 때쯤 스탠포드대학은 샌프란시스코에 있는 의대를 본교가 있는 팔로알토 캠퍼스로 이전하고 의과학을 학교 발전의 모토로 하여 학교발전을 이룩하기 위한 지잡대탈피원대한 계획을 세웠다. 이런 빅픽챠의 한 그림으로써 생화학과 (Department of Biochemistry)를 키우기로 했고, 생화학과의 학과장으로 당시 Washington University of St. Louise (흔히 ‘와슈’ 라고 하는)에서 스타 생화학자로 발돋움하기 시작한 아서 콘버그를 초빙하기로 했다.

아서 콘버그는 이미 대사 관련 각종 효소의 생화학자로 널리 이름이 알려져있는 상태였으며, 그가 스탠포드로 초빙 오퍼를 받은 시점은 1959년 DNA Polymerase로 N모상을 받은 시점이었다!
그는 스탠포드 대학에 학과장으로 임용되면서 매우 강력한 권한을 가졌는데, 그가 워싱턴대학에서 초빙한 5명의 ‘콘버그와 아이들’ (그중 두 명은 콘버그의 포닥이었고, 세 명은 콘버그가 파스퇴르 연구소에서 영입한 사람들이었다) 을 그대로 생화학과 교수로 임용하는 것이었다. 그는 이렇게 ‘자기 사람’ 을 학과에 심는 것뿐만 아니라 스탠포드 생화학과를 일종의 ‘공동체’처럼 운영하였는데 여기에는 장비와 시약의 자유로운 이용, 프로젝트의 공유, 심지어 각자 수주한 연구비를 모두 통괄하여 운영하는 그런 시스템이었다고 한다.
이렇게 스탠포드 생화학과를 ‘DNA 연구의 메카’로 만들고, 그 내에서 자유로운 정보교환과 시료의 교환 등이 이루어지게 했다고 한다. 그런데 이러한 환경이 어떻게 유전공학 기술의 개발과 이어지는가.
폴 버그 (Paul Berg) 와 진핵생물 분자생물학으로의 이전
1960년대 말까지의 분자생물학은 주로 ‘센트럴 도그마’ 라고 불리는 DNA 복제 – 전사 – 번역에 이르는 유전정보가 어떻게 단백질로 전달되는가에 촛점을 맞추어서 연구가 되었으며, 이때 주된 모델시스템은 주로 대장균 (Escherichia coli) 와 대장균 유래의 파아지(coliphage)였다.
그러나 이러한 상황은 1960년대 말에 이르러서 변화를 겪게 되는데 여기에는 크게 두 가지 요인이 있다. 첫 번째는 1960년대 중반에 이르러 유전암호(Genetic Code)가 규명되고 대개의 분자생물학자는 ‘이제 분자생물학으로 풀 수 있는 것은 대개 다 푼 것이 아닌가’ 라는 생각을 하게 되었다.
또 다른 요인은 2차대전 이후 급증한 생명 의학계의 투자에 반해서 직접적인 질병에 대한 치료법의 발견은 상대적으로 더디었으며, 이에 따른 ‘생명 의학에 보다 관련 있는 연구를 하시지?’ 하는 압력의 증대였다. 특히 지금은 ‘래스커 상’(Lasker Award)으로 이름이 남은 유명한 헬스케어 관련 로비스트이자 사회활동가인 매리 래스커 등에 의해 암 연구와 같은 보다 질병에 밀접한 연구에 집중적으로 정부는 지원해야 한다는 압력이 증대되었다.
이런 상황에서 스탠포드 생화학과의 ‘콘버그 사단’의 일원이었던 폴 버그 (Paul Berg)는 자신이 그동안 연구하던 람다 파지(Lambda Phage)에 대한 경험을 바탕삼아 자신의 연구방법을 동물바이러스인 SV40 에 적용해 보기로 한다. 처음 그는 박테리오파지에서 사용했던 생화학적인 방법론을 동물바이러스와 동물세포 시스템에서 시험해보려고 했으나, 동물바이러스는 박테리오파지에서 사용하던 방법처럼 단백질을 순수정제하여 시험해보기에는 너무 복잡하다는 것을 깨달았다. 그렇다면 어떻게 연구를 할 수 있을까?
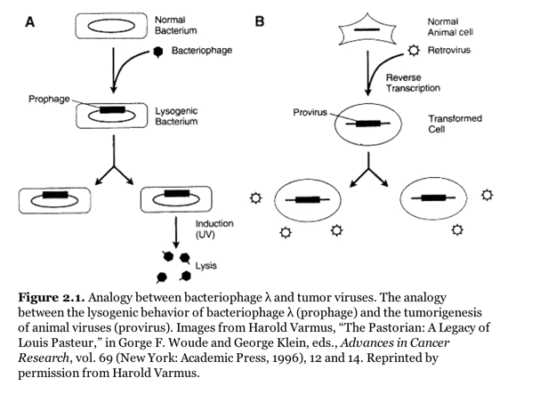
폴 버그는 박테리아와 박테리오파지 연구에서 Transduction, 즉 박테리오파지를 이용하여 박테리아의 유전체 일부를 옮기는 과정이 박테리아 유전학 발전에 매우 기여했음을 생각하고, 동물바이러스인 SV40에서 비슷한 연구를 수행하여 SV 40의 유전자 구조를 파악할 수 없을까 하는 생각을 한다.
즉 그는 동물바이러스 SV40을 최근에 발견된 R1 Endonuclease (요즘 EcoRI이라고 불리는 것이다)이라는 DNA 분해효소로 자르고, 이것을 학과의 냉장고(콘버그의 생화학과에서는 대개의 실험에 필요한 효소들을 자유롭게 공유한다는 사실을 생각해보자)에 있는 각종 DNA 관련 효소로 처리하며 람다 박테리오파지와 SV40 바이러스가 합쳐진 ‘키메라’ 바이러스를 만들 수 있지 않을까 하는 아이디어를 얻는다.
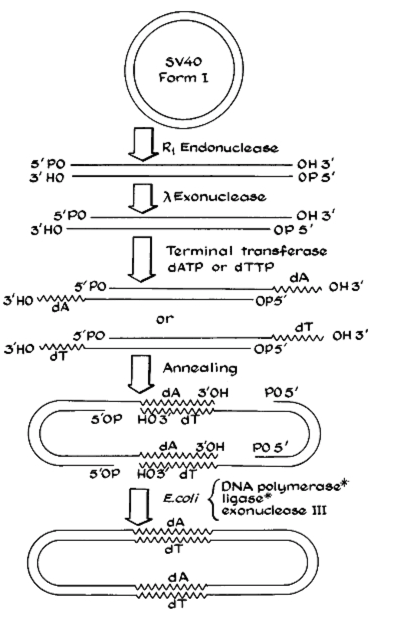
이와 비슷한 연구들이 폴 버그의 연구실에서 진행되고 있었는데, 박사과정 학생이었던 Peter Lobban이라는 학생은 다른 박테리오파지인 P22의 DNA를 자른 후, 이것을 시험관 내에서 붙일 수 있다는 사실을 보여주었다. 그러나 아직은 그들은 이렇게 ‘재조합된’ DNA를 실제로 세포 안에 넣지는 않은 상태였다.
재조합 바이러스와 불거진 생명윤리
1971년도에 폴 버그의 연구실에 SV40을 이용하여 재조합 DNA 실험을 하려고 하던 학생은 자네트 머츠(Janet Mertz) 라는 박사과정 학생이었다. 그는 스탠포드대 생화학과의 다른 랩의 포닥에게서 얻은 박테리오파지 유래의 벡터를 이용하여 SV40과 박테리오파지 DNA를 합치는 연구를 할 생각이었다. 그는 (1) 박테리오파지 DNA를 SV40에 넣어서 동물 세포에서 증식하도록 하는 연구와 반대로 (2) SV40 유래의 DNA를 박테리오파지에 넣어서 박테리아 내에서 증식하도록 하는 연구를 계획했다.
그는 스탠포드 대학 내에 있는 효소 (역시 콘버그의 냉장고) 들을 조합하여 시험관 내에서 SV40과 박테리오파지 DNA를 서로 붙일 수 있다는 것을 확인했고, 이 결과를 1972년의 콜드 스프링스 하버 (Cold Springs Harbor) 미팅에서 발표했다.
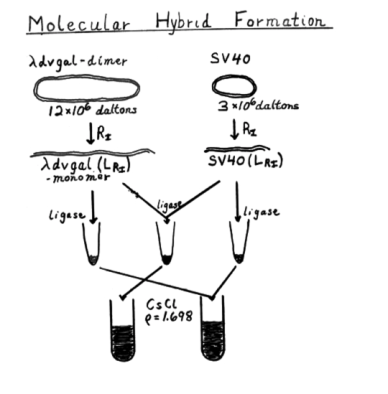
그러나 이 발표를 들은 많은 과학자들의 우려가 바로 들어왔다. 암을 유발할 수 있는 동물바이러스의 유전자를 대장균에 넣는다고? 만약 이 대장균이 감염되서 장내에서 암 바이러스의 전염원이 되면 어쩔 것인가? 이러한 우려는 매우 심각하게 받아들여졌고, 결국 폴 버그는 예정된 실험을 중지하고, 1973년과 1975년에 두 차례에 걸친 아실로마 컨퍼런스에서 DNA 재조합 연구의 안전성에 대한 것을 논의하게 되었다. 당연히 재조합 DNA 를 만들어서 이것을 생체내에서 복제하려는 연구는 지연될 수 밖에 없었다. 대학원생은 뭔 죄야 ㅠㅠ
스탠포드 생화학과에 끼어든 타과 사람과 타학교 연구자
이러던 도중에 중간에 끼어든 연구자들이 있었으니 한 명은 스탠포드의 유전학과 (Department of Genetics)에 재직하던 스탠리 코헨 (Stanley N. Cohen) 이고, 다른 사람은 UCSF의 생화학자인 허버트 보이어 (Herbert Boyer) 이다. 스탠리 코헨은 플라스미드(Plasmid)라는 세균 유래의 작은 DNA 조각에 관심이 있었고, 이들 플라스미드가 많은 경우 항생제에 내성을 띄는 유전자를 가지고 있음을 발견하였다. 허버트 보이어 (Herbert Boyer) 는 대장균에서 EcoRI이라는 제한효소를 처음 발견하였다.이렇게 보이어의 효소는 이미 폴 버그의 연구실에서 사용되고 있던 상태였다.
둘이 모르던 상태였던 코헨과 보이어는 1972년 하와이의 학회에서 처음 만나, 그 둘의 기술을 조합하면 유전자 재조합을 좀 더 쉽게 할 수 있다는 것을 깨달았다. 즉 코헨은 항생제 내성을 가지고 있는 플라스미드를 가지고 있고, 보이어는 플라스미드를 자를 수 있는 효소를 가지고 있다. 지금까지 재조합 DNA 분자를 만드는 것은 가능했으나, 과연 어떻게 재조합 DNA 분자가 형질전환된 대장균, 그리고 원하는 재조합 DNA가 들어가 있는 대장균을 찾을 것인가?
이들은 항생제 내성을 마커로 이용하여, 항생제 내성을 새로 가지게 된 대장균을 이용하여 재조합 DNA 분자가 형질 전환된 콜로니만을 선별할 수 있다는 획기적인 아이디어를 내게 되었다. 사실 유전자 가지고 일해본 사람이면 항생제 저항성 마커가 든 플라스미드를 박테리아에 넣고 이것을 항생제가 들어있는 배지에서 선별하는 것은 너무 당연한 일처럼 생각한다. 그러나 이 당연한 아이디어라는 것은 코헨과 보이어가 만나기 전에는 개념조차 없었던 것이다.
그리하여 폴 버그의 랩에서 원래 유전자 재조합 실험을 준비하던 자네트 머츠 등이 생명윤리의 벽에 부딫혀 실제로 실험을 진행하지 않던 사이에 코헨과 보이어는 앞서나가서 실제로 재조합 DNA를 살아있는 대장균에 넣게 된 것이다. 그리고 코헨과 보이어는 폴 버그의 경우와는 달리 암을 유발하는 SV40 과 같은 민감한 바이러스를 사용한한 것도 그들이 가진 큰 강점일 것이다.
그렇게 하여 1973년부터 1974년 동안 총 3편의 논문이 출현하였다.

첫번쨰 논문에서는 코헨이 자연계에서 분리한 플라스미드인 R6-5 에서 불필요한 부분을 잘라내서 만들어진 pSC101 이라는 ‘최초의 인간 손을 거친 재조합 클로닝 벡터’ 를 기술하고 있다.

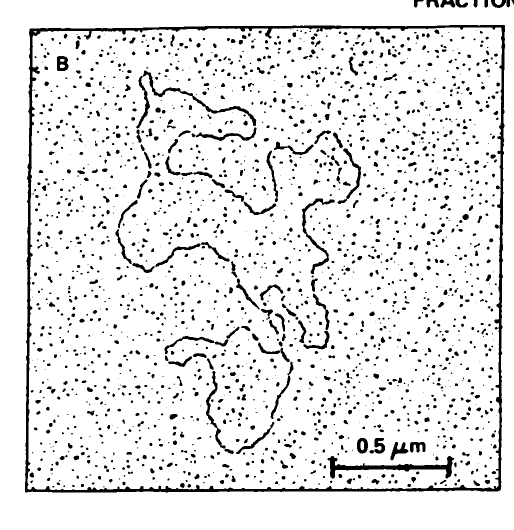
플라스미드가 한 가닥으로 이어져 있음을 입증하기 위해서 찍은 전자현미경사진 -.-
이 뒤를 이어 코헨은 이종생물인 포도상구균 (Staphylococcus) 유래의 플라스미드와 개구리의 rRNA가 들어간 플라스미드를 만들어 대장균에서 증식시킴으로써 최초의 재조합 DNA를 구성하여 박테리아 내에서 증식시킬 수 있음을 보인다.
그렇게 해서 결국 코헨과 보이어는 재조합 DNA 기술의 개발자로 널리 알려지게 되었지만 정작 재조합 DNA 기술의 시작점이 된 폴 버그와 스탠포드의 생화학자들의 공로는 뒷전에 묻히게 된 점이 있다. 만약 폴 버그가 1980년 노벨 화학상에서 재조합 DNA 기술의 공로로 상을 타지 못했더라면 스탠포드 생화학자들의 업적은 그냥 무시당했을 수도 있겠으나 그나마 노벨상이 이들에게 위안이 된 셈이다. 보이어와 코헨은 둘 다 N모상을 타지 못했다. (동명의 Stanley Cohen이라는 사람이 1986년 노벨 생리의학상을 타서 혼동을 할 수도 있는데, 이 사람은 재조합 DNA와는 관련 없는 연구를 한 사람이다)
유전자 클로닝의 모럴과 경제학
사실 이러한 재조합 DNA 기술의 아이디어가 탄생하기 위한 중요한 여건이라면 아서 콘버그가 만들어놓은 개방적이고도 공유경제적인 학과의 환경을 들 수가 있다. 즉 학과의 냉장고에 있는 누군가의 시료 (효소)도 자유롭게 꺼내서 사용할 수 있고, 아이디어를 자기 랩만의 비밀로 붙이지 않고 공유하고 협력하는 과정을 통해서 DNA 재조합 기술이 개발된 것이다. 당연히 스탠포드의 생화학자들은 이렇게 하여 탄생한 코헨의 플라스미드 벡터 역시 그들의 공동창작물이라고 생각했던 것 같다.
그러나 여기서 문제가 야기되는데, pSC101 이라는 최초의 플라스미드 벡터를 가지게 된 코헨은 이것에 대해서 일종의 독점권 같은 것을 행사하려 시도했다. 즉 생화학과가 아닌 유전학과에 소속되어 있었고, 아직 테뉴어를 받지 못하여 상대적으로 스탠포드 생화학과에 있는 사람들보다 학교에서 불안정한 위치에 놓였던 코헨은 스탠포트의 생화학자들에게 자신의 플라스미드를 자유롭게 배포하기보다는 제한을 걸려고 하였으며, 그들의 공동체간에 자유롭게 시료를 주고받는 것을 미덕으로 삼았던 스탠포드의 생화학자들은 이에 크게 반발하였다.
이 책의 4챕터에서는 스탠포드 생화학과에서 초라피의 발생생물학에 최초로 분자생물학적 기법을 도입하여 초파리의 유전자를 처음으로 클로닝하려고 시도했던 David S Hogness 라는 사람이 코헨과 벌인 갈등을 서술하고 있다. 그는 스탠포드 생화학과의 일원으로써, 생화학과의 지적 산물에서 탄생한 플라스미드를 당연히(!) 코헨에게 요구하였으나, 코헨은 자신의 클로닝 논문이 나오기 전까지 플라스미드를 줄 수 없다고 버텨서 갈등이 벌어졌다. 그러나 코헨은 결국 자신의 논문이 나오기 몇 주 전에 플라스미드를 제공했다고 한다.
그리고 이러한 갈등은 추후에 코헨과 보이어가 소속된 스탠포드와 UCSF가 특허를 출원하고자 할 때 불거진다. 스탠포드 학교 당국은 특허에 소극적이던 코헨과 보이어를 설득하여 특허 출원을 시도하였고, 특허에는 코헨과 보이어 이외의 다른 사람들의 기여는 들어가지 않음으로써, 스탠포드 생화학과의 다른 연구자들과 코헨-보이어의 갈등은 더욱 심해진다.
이와 더불어 재조합 DNA 기술을 이용하여 뭔가 부가가치를 창조할 수 없을까 하는 이야기들이 제시되고, 젊은 벤처 투자가인 로버트 스완슨은 최근에 아실로마 컨퍼런스에 참석한 사람의 명단을 A부터 차례로 연락하여 회사를 설립할 수 있을지를 타진하기 시작하였다. 그러나 대개의 사람들은 터무니없는 이야기로 무시하거나, 폴 버그와 같은 사람들은 국가의 연구비로 수행된 연구비로 생산된 연구결과로 사익을 취하는 것 자체를 경멸하는 태도를 보였으나, 버그 다음에 나온 보이어의 경우 스완슨에게 10분 정도의 시간을 내주었고, 그들의 만남은 3시간으로 길어졌다.

그리고 그들은 각자 500불씩 내서 회사를 세우기로 했는데, 그 회사는 후에 Genetech가 된다. 코헨 지못미 B자가 C자보다 끝발이 딸려서
연구 환경의 변화
1950년대 이후 미국의 의생명과학의 지속적인 발전을 이루던 환경도 점점 변하기 시작하였다. 1960년대부터 질병에 대한 특이적인 치료법을 요구하는 사회단체들의 목소리들이 강화되기 시작하고, 이들의 로비에 의해서 1971년 닉슨 행정부는 ‘암과의 전쟁’을 선포하고 미국 독립 200주년인 1976년까지 암을 정복하겠다는 (…) 야무진 계획을 세우고, 암 분야에 막대한 연구비를 쏟아붓기 시작하였다. 물론(…) 암의 실체도 정확히 모른 상태에서 쏟아붓는 연구비로 딱히 뚜렷한 성과가 나오지는 못했다는 것은 다들 알고 있을 것이다.
하여튼 이렇게 변화된 환경에서 일종의 ‘공유경제’를 형성하던 스탠포드의 생화학자들의 커뮤니티 역시 변하기 시작하였다. 특히 1970년대 미국 경제의 침체로 연구비 증가가 정체되고, 그리고 옆 동네(…) 의 돈벼락 (Genetech 는 1980년에 상장하고, 보이어는 일순간에 수천만 불의 재산을 가진 재산가가 된다) 을 보면서 아서 콘버그를 포함한 스탠포드의 생화학자들은 국가의 연구비만을 믿고서는 안 되겠으니 우리가 뭔가 해봐야 하지 않겠는가 하는 생각을 하게 되었다.
이렇게 해서 이루어진 여러 가지 시도 중의 하나가 DNAX 라는 회사의 설립이었다. 이 회사는 상업적인 뚜렷한 목적의식을 가지고 세워진 회사라기보다는 콘버그, 폴 버그, 찰스 야노프스키와 같은 스탠포드의 과학자들을 중심으로 한 ‘과학 연구’를 위한 지속적인 펀딩을 위한 회사였다. 즉 정부의 연구비에 의존하지 않은 연구를 수행하고, 여기서 나온 산물을 가지고 별도의 벤처를 수립하여 산업화를 한다는 구상이었다.
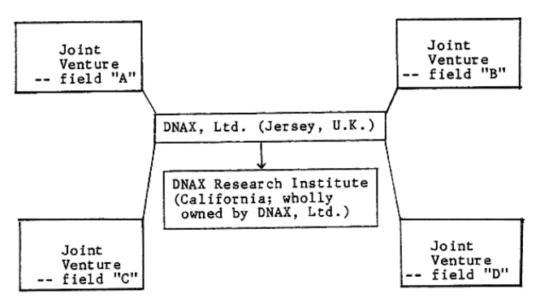
그러나 이렇게 설립된 회사는 그리 오래 가지 못하였다. 결국 이 회사는 설립된 지 2년도 안되어 빅파마인 schering-Plough 에 인수된다. 요즘 생각하면 구체적으로 ‘뭘 한다’ 라는 계획도 없이 그저 분자생물학적인 방법론을 이용하여 회사를 세우고 오래 가기를 바라는 것 자체가 이상하게 보일 일이지만…
아무튼 이러한 시도는 정부의 연구비에 독립한 자신들만의 문화를 유지시키기 위한 하나의 고육책 (결국은 실패했지만) 의 하나로써 시도된 의의 정도는 있으리라고 생각된다.
새로운 산업의 탄생
이 책은 유전자 조작 기술이라는 기존에는 전혀 존재하지 않았던, 새로운 산업 자체를 일으킨 기술이 어떤 과정을 통해서 만들어지는지를 잘 보여준다. 즉 기술 자체의 산업적인 성숙 과정보다는 산업 자체를 일으킬 기술이 어떻게 기초과학적인 탐구의 욕망 속에서 ‘우연치 않게’ 나오는 과정을 매우 생생하게 보여주고 있다.
이러한 과정들은 적어도 생명공학 관련해서 장차 큰 산업을 형성하는 발견에서 공통적으로 보여지고 있다. 즉 처음에는 아무런 응용과 관련된 기대 없이 기초과학을 수행하기 위해서 개발된 기술들이 점점 여러 사람들의 아이디어를 통해서 성숙되고, 그 기술이 어느정도 숙성하면 외부의 경제적인 동인을 가진 투자자 등이 달려 들어와서 본격적인 상업적 기술개발 단계로 전이하는.
그러나 결국 문제는 아무리 경제적인 동인을 가지고 있는 사업가가 존재하고 자본이 있어도 독창적이고 혁신적인 기초과학 연구결과가 없으면 재조합 DNA와 같이 기존에는 존재하지 않던 산업을 백지에서 만들어 내는 ‘창조경제’란 불가능하다는 것을 잘 보여준다. 이러한 창조경제의 역할에서 정부가 한 일은 무엇일까?
결국, 이것은 2차 세계대전 이후 미국의 국가주도의 연구개발이 시작되며 투자한 기초과학 연구의 성과라고 볼 수 있을 것이다. 국가가 주도하여 ‘재조합 DNA 기술’을 개발하라고 탑다운 연구비를 설정한 것도 아니요, 샌프란시스코를 중심으로 한 베이 에리어에 ‘재조합 DNA 기술 테크벨리’ 를 개발한 것도 아니다. 정부는 그저 어느 정도의 연구비를 연구자들에게 지속적으로 공급하여 자기가 하고 싶은 연구를 하게 한 것뿐이며, 이러한 연구 결과 중에서 의도치 않게 성숙된 결과물이 투자가와 기업가의 눈에 띄어서 본격적으로 산업화의 길을 가게 된 것이다.
반면 이 당시에 미국의 국책과제로 추진되었던 목적 지향적인 프로젝트였다는 “War on Cancer’가 결국은 그 당시에는 별반 성과를 내지 못하고, 실질적으로 의생명과학에 퍼부은 R&D 결과가 실제 암 생존율의 상승으로 나타난 것은 약 20~30년이 지난 1990년대 중반은 되어서였다. 즉 과학에 대한 투자는 생각만큼 빨리 효과를 나타내기는 힘들다.
오히려 “War on Cancer” 가 가져다준 가시적인 이익이라면 원래 기대했던 암에 대한 치료보다는 “War on Cancer”에서 암의 타겟이 아닐까 하고 디립다 연구했던 레트로바이러스에 대한 축적된 연구 때문에 1980년대에 급격히 등장한 HIV/AIDS에 대한 대책이 비교적 빨리 나왔다는 것이 아닐까. 과학에 대한 투자와 그 결과는 손쉽게 예측할 수 없느니라.
아무튼 이 책은 재조합 DNA 기술의 역사에 대해서 관심이 있는 과학도, 혹은 과학사학도, 그리고 어떻게 하면 혁신적인 기술로 산업화를 하고 싶은 기업가, 그리고 어떻게 산업을 만들 새로운 기초과학의 성과가 발견되는지를 알고 싶은 많은 대중들에게도 권하고 싶다. 그런데 아직 번역이 안 된 것이 흠이랄까… (그냥 한국어로 이 주제로 대중서 좀 쓰시면 안 될까요? 저자님?)
